Окислительный метод очистки применяют для обезвреживания производственных сточных вод, содержащих токсичные примеси (цианиды, комплексные цианиды меди и цинка) или соединения, которые нецелесообразно извлекать из сточных вод, а также очищать другими методами (сероводород, сульфиды).
В узком смысле окисление – реакция соединения какого-либо вещества с кислородом, а в более широком – всякая химическая реакция, с отнятием электронов от атомов или ионов. В практике обезвреживания производственных сточных вод в качестве окислителей используют хлор, гипохлорит кальция и натрия, хлорную известь, диоксид хлора, озон, технический кислород и кислород воздуха, пероксид водорода.
Активность вещества как окислителя определяется значением окислительного потенциала. Из всех известных в природе окислителей первое место занимает фтор, который, однако, из-за высокой агрессивности не может быть использован на практике. Для других веществ значение окислительного потенциала: для озона – 2,07; для хлора – 0,94; для пероксида водорода – 0,68; для перманганата калия – 0,59.
Окисление активным хлором. Обезвреживание сточных вод хлором или его соединениями – один из самых распространенных способов их очистки.
При введении хлора в воду образуется хлорноватистая и соляная кислоты:
Cl2 + H2O = HOCl + HCl.
Далее происходит диссоциация хлорноватистой кислоты, степень которой зависит от рН среды. При рН > 4 молекулярный хлор практически отсутствует:
HOCl 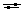 H+ + OCl-.
H+ + OCl-.
Соотношение между недиссоциированной хлорноватистой кислотой HOCl и ионами гипохлорита OCl- в воде при различных значениях pH показано на рис. 3.4.
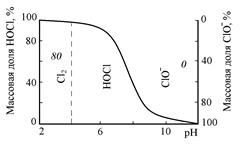
Рис. 3.4. Концентрация HOCl и ClO- в воде при изменении значения pH
Сумма Cl2 + HOCl + OCl- называется свободным «активным» хлором.
В присутствии аммонийных соединений в воде образуется хлорноватистая кислота, хлорамин NH2Cl и дихлорамин NHCl2. Хлор в виде хлорамина называется связанным «активным» хлором.
Процесс хлорирования проводят в хлораторах периодического и непрерывного действия, напорных и вакуумных (рис. 3.5).
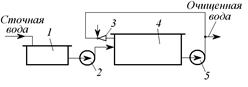
Рис. 3.5. Схема установки для очистки воды хлорированием:
1 – усреднитель; 2 и 5 – насосы; 3 – инжектор; 4 – емкость
Хлорирование проводится в емкости, включенной в систему циркуляции. В инжекторе газообразный хлор захватывается сточной водой, циркулирующей в системе до тех пор, пока не будет достигнута заданная степень окисления, после чего вода выводится для использования.
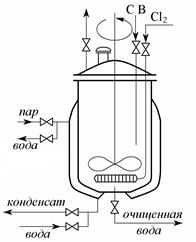
Процесс хлорирования с успехом проводят в реакторе с мешалкой (рис. 3.6, прил. 1).
 Очистка сточных вод от цианидов основана на их окислении в менее токсичные (приблизительно в 1000 раз) цианат-ионы с их последующим гидролизом в нейтральной среде до
Очистка сточных вод от цианидов основана на их окислении в менее токсичные (приблизительно в 1000 раз) цианат-ионы с их последующим гидролизом в нейтральной среде до 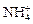 и
и 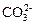 по следующим реакциям:
по следующим реакциям:
при рН ≥ 9-10:
CN- + 2OH- + Cl2 → CNO- + H2O + 2Cl-, (3.19)
при рН ≈ 7:
CNO- + 2H2O → 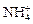 +
+ 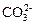 . (3.20)
. (3.20)
Образующиеся цианаты можно окислить до элементарного азота и диоксида углерода:
2CNO- + 4ОН- + 3Cl2 → 2CO2↑ + 6Cl- + N2↑ + 2H2O. (3.21)
При снижении рН возможно протекание реакции прямого хлорирования цианида с образованием токсичного хлорциана:
CN- + Cl2 → CNCl + Cl-. (3.22)
В кислой среде (рН ≤ 6,5) эта реакция протекает с достаточно высокой скоростью и может быть описана следующим уравнением:
2CNO- + 3ClО- + 2H+ → 2CO2↑ + 3Cl- + N2↑ + H2O. (3.23)
При использовании в качестве окислителей гипохлоритов реакцию проводят при рН = 10-11
CN- + OCl- → CNO- + Cl-. (3.24)
Активный хлор окисляет находящиеся в сточных водах соединения аммония, аммиак и органические вещества, содержащие аминогруппы до моно- и дихлораминов, а также до треххлористого азота по следующим реакциям:
NH3 + HOCl → NH2Cl + H2O, (3.25)
NH2Cl + HOCl → NHCl2 +H2O, (3.26)
NHCl2 + HOCl → NCl3 + H2O. (3.27)
Возможна обработка циансодержащих сточных веществ диоксидом хлора ClO2 , который обладает высокой окислительной способностью. Следует отметить, что при обработке сточных вод диоксидом хлора не образуются высокотоксичный хлорциан, хлорфенол и другие продукты прямого хлорирования при любых значениях рН среды.
В качестве примера укажем реакцию окисления комплексного цианида меди:
5[Cu(CN)3]2- + 7ClO2 + 12OH- →
→ 15CNO- + 7Cl- + 5Cu(OH)2 + H2O. (3.28)
Рекомендуется проводить реакцию окисления цианидов ClO2 при рН ≥ 10.
Хлорирование применяется и для дезодорации сточных вод целлюлозно-бумажных комбинатов. Указанные сточные воды содержат сероводород, сульфиды, метил, метилмеркаптан и др.
В щелочной среде хлор окисляет сульфиды до сульфатов. Процесс может быть описан следующим уравнением:
Na2S + 4Cl2 + 8NaOH → Na2SO4 + 8NaCl + 4H2O. (3.29)
В кислой и нейтральной среде образуются сульфиты:
H2S + 3Cl2 + 3H2O → H2SO4 + 6HCl, (3.30)
NaHS + 3Cl2 + 3H2O → NaHSO3 + 6HCl. (3.31)
При окислении метилмеркаптана в зависимости от расхода хлора образуются различные продукты:
2CH3SH + Cl2 → CH3SSCH3 + 2HCl, (3.32)
CH3SH + 2Cl2 + H2O → CH3SOCl + 3HCl, (3.33)
CH3SH + 3Cl2 + 2H2O → CH3SO2Cl + 5HCl. (3.34)
При обезвреживании циансодержащих сточных вод дозу активного хлора принимают из расчета 2,73 мг на 1 мг цианидов цинка, никеля, кадмия, синильной кислоты и простых цианидов, и 3,18 мг/мг – для комплексных цианидов меди с избытком не менее 5 мг/л.
При введении перед отстойниками полиакриламида (доза 20 мг/л 0,1 %-го раствора) время отстаивания сокращают до 20 мин. Доля активноого хлора в рабочих растворах реагентов должна быть 5-10 %. Время контакта сточных вод с реагентами 5 мин – при окислении простых цианидов и 15 мин – при окислении комплексных цианидов. После обработки сточных вод активным хлором их необходимо нейтрализовать до рН = 8-8,5.
Установки для хлорирования состоят из узлов: испарения жидкого хлора, дозирования газообразного хлора и обезвреживания хлорной воды (в водохлорном эжекторе). Хлор растворяется в воде только в газообразном состоянии, поэтому жидкий хлор испаряют в емкостных или змеевиковых испарителях. На испарение 1 кг жидкого хлора расходуется 0,4 м3 воды при 10 оС и 0,15 м3 воды при 30 оС. Хлор испаряют в хлораторах. Характеристика хлораторов ЛК приведена в табл. 3.5.
Для обеззараживания сточных вод из хлорсодержащих реагентов готовят водный раствор, смешивают его со сточной водой и смесь направляют в контактные резервуары. При проектировании хлоратной установки расход хлорной извести определяют по зависимости
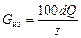 . (3.35)
. (3.35)
Объем хлорного раствора определяют по формуле
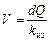 , (3.36)
, (3.36)
где d – доза активного хлора в реагенте, кг/м3; Q – расход сточных вод, м3/ч; z – доля активного хлора в хлорной извести, %; k из – концентрация раствора хлорной извести, кг/м3.
Составы окислителей приведены в табл. 3.6 и 3.7.
Хлорный раствор приготовляют в растворных баках. Вместимость растворных баков:
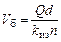 , (3.37)
, (3.37)
где 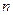 – число затворений хлорной извести в сутки (
– число затворений хлорной извести в сутки (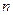 = 2-6).
= 2-6).
Баки для хранения раствора имеют вместимость не более 50 % растворных. Дозирующие баки имеют размеры: 0,5 × 0,4 × 0,5 м. Арматуру и трубопроводы для подачи хлорной воды изготавливают из антикоррозионных материалов. Контактные резервуары бывают горизонтальные, вертикальные или укрупненные квадратные с ячеистым дном. Конструктивно они не отличаются от отстойников. Время контакта 30 мин.
| Таблица 3.5 Характеристика хлораторов марки ЛК | ЛК-12 | 2,5-50 30-35 0,6-0,8 1,5 280×760×330 | Примечание. В названии марки хлоратора: М – малая мощность, С – средняя и Б – большая. |
| ЛК-10Б | 2,5-25 17-30 0,1-0,55 800×340×200 | ||
| ЛК-11 | 0,5-5 3-5 0,175-0,5 1,5 500×200×125 | ||
| ЛК-10С | 0,85-5,5 3-5 0,175-0,5 1,5 530×520×60 12,5 | ||
| ЛК-10М | 0,04-0,85 3-5 0,175-0,5 0,3 530×520×60 12,5 | ||
| Показатель | Производительность, кг/ч Расход воды, м3/ч Напор воды, МПа Максимальная концентрация хлорной воды, г/л Диаметр трубопровода, мм: подводящего воду отводящего хлорную воду трубки для хлора Габаритные размеры, мм Масса, кг |
Таблица 3.6
Состав хлорной извести
| Показатель | Марка | ||
| А | Б | В | |
| Доля активного хлора, %, не менее Доля влаги, %, не более: при длительном хранении при непродолжительном хранении | не нормируется | не нормируется не нормируется |
Таблица 3.7
Состав гипохлорита кальция и дветретиосновной соли
| Показатель | Сорт гипохлорита кальция | Сорт дветретиосновной соли | |||
| I | II | III | I | II | |
| Доля активного хлора, %, не менее Нерастворимый остаток, %, не более Доля влаги, %, не более | 50 55 50 Не нормируется 3 1 1,5 | ||||
Озонирование. Процессы озонирования применяют для очистки сточных вод от фенолов, нефтепродуктов, сероводорода, соединений мышьяка, ПАВ, цианидов, красителей, ароматических углеводородов, пестицидов и др. Одновременно с очисткой происходит обесцвечивание воды, обеззараживание, устранение привкусов и запахов. Озон подают в сточную воду в виде озоновоздушной или озоно-кислородной смеси. Доля озона в смеси составляет приблизительно 3 %.
Рассмотрим типичные реакции, протекающие при очистке сточных вод озонированием. Окисление сероводорода протекает следующим образом:
H2S + O3 → H2O + SO2 , (3.38)
3H2S + 4O3 → 3H2SO4 . (3.39)
Роданид-ионы реагируют с озоном по следующей схеме:
CNS- + 2O3 + 2OH- → 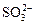 + 2O2 + H2O + CN-, (3.40)
+ 2O2 + H2O + CN-, (3.40)
CN- + 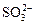 + 2O3 → CNO- +
+ 2O3 → CNO- + 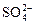 + 2O2 . (3.41)
+ 2O2 . (3.41)
Этот процесс следует проводить в нейтральной и слабокислой среде при 5-25 оС.
Аммиак при взаимодействии с озоном в щелочной среде окисляется до азотной кислоты и воды по реакции
NH3 + 4O3 → 4NO3- + 4O2 + H2O + H+. (3.42)
Цианиды в слабощелочной среде, реагируя с озоном, образуют первоначально менее токсичные цианаты, которые затем гидролизуются в воде или окисляются озоном в соответствии со следующими уравнениями:
CN- + O3 → CNO- + O2↑. (3.43)
CNO- + 2H+ + 2H2O → CO2↑ + H2O + 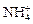 , (3.44)
, (3.44)
CNO- + 2H2O → 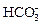 +NH3 , (3.45)
+NH3 , (3.45)
2CNO- + H2O + 3O3 → 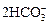 + 3O2↑ + N2↑. (3.46)
+ 3O2↑ + N2↑. (3.46)
Озон получают в промышленных озонаторах-генераторах из кислорода воздуха под действием электрического разряда. Электроды озонаторов могут быть трубчатой или пластинчатой формы и обычно изготавливаются из металлизированного стекла. Технические характеристики отечественных озонаторов трубчатого типа приведены в табл. 3.8.
Таблица 3.8
Технические характеристики отечественных озонаторов
| Тип озонатора | Производительность, кг/ч | Доля озоновоздушной смеси, % | Расход воздуха, м3/ч | Расход охлаждающей воды, м3/ч | Напряжение на электродах, кВт |
| ОП-4 ОП-6 ОП-121 ОП-315 ОПТ-510 | 1,6 3,8 | 16-17 14-16 14-16 12-14 12-14 |
Озон из генератора в виде озоно-воздушной смеси направляется в контактную камеру и смешивается с обрабатываемой сточной водой. Циркуляция обрабатываемой сточной воды и озоновоздушной смеси в контактной камере реакции во встречном направлении обеспечивает большую эффективность озонирования. Реакционные камеры могут быть одно- и двухступенчатыми.
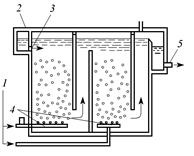 | Рис. 3.7. Схема установки озонирования производственных сточных вод: 1 – подача озоновоздушной смеси; 2 – контактная камера озонирования сточных вод; 3 – подача необработанных сточных вод; 4 – пористые распределительные трубки; 5 – выпуск озонированных сточных вод |
Генераторы озона подразделяются на цилиндрические с трубчатыми горизонтальными или вертикальными электродами (рис. 3.8); плоские с пластинчатыми электродами и центральным коллектором (рис. 3.9).
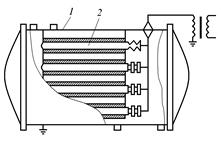 Рис. 3.8. Озонатор с горизонтальными трубчатыми элементами: 1 – корпус; 2 – трубчатый элемент Рис. 3.8. Озонатор с горизонтальными трубчатыми элементами: 1 – корпус; 2 – трубчатый элемент | 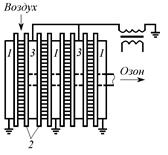 Рис. 3.9. Пластинчатый озонатор с центральным коллектором: 1 – полые бруски; 2 – стеклянные пластины; 3 – высоковольтные электроды Рис. 3.9. Пластинчатый озонатор с центральным коллектором: 1 – полые бруски; 2 – стеклянные пластины; 3 – высоковольтные электроды |
Озонаторные установки для очистки сточных вод состоят из аппаратов для очистки и осушки воздуха, озонаторов, камер контакта озона с обрабатываемой водой, оборудования для утилизации остаточного озона. Атмосферный воздух подают на фильтр, где он очищается от пыли, после чего направляется в водоотделитель капельной влаги, а затем осушается на адсорбционных установках АГ-50 или УОВ. Осушенный воздух подвергается тонкой очистке от пыли, а затем направляется в озонатор.
На установках производительностью более 6 кг/ч озона применяют двухступенчатую схему осушки воздуха. На первой ступени удаляют влагу, искусственно охлаждая воздух до 7 оС в холодильной установке, на второй – осушают в адсорберах с алюмогелевой или силикагелевой загрузкой до влажности 0,05 г/м3.
В обрабатываемую воду озон вводят различными способами: барботированием воздуха, содержащего озон, через слой воды (распределение воздуха происходит через фильтросные пластины или пористые трубки); смешением воды с озоновоздушной смесью в эжекторах или специальных роторных механических смесителях, в абсорберах различной конструкции (рис. 3.10).
Высота колонны Н не превышает 4-5 м. Коэффициент поглощения озона определяют по формуле
η = 1 – (1 – 0,1 H 1)β ; (3.47)
β = - (0,113 – 0,0017 t) 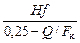 , (3.48)
, (3.48)
где Н 1 – высота слоя воды в колонне, м; t – температура воды, оС; f – отношение поверхности пузырька к его объему, мм-1; Q – расход воды, м3/ч; F к – площадь сечения колонны, м2.
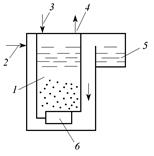 | Рис. 3.10. Барботажная колонна: 1 – контактная камера; 2 – сточная вода; 3 – озоновоздушная смесь; 4 – отвод непрореагировавшего озона; 5 – сборный канал; 6 – диффузор |
Колонна с пористыми трубками имеет в плане размер 1,7×5 м. По дну проложены трубы с внутренним диаметром 70 и наружным 120 мм. Размер пор 100 мкм.
Общая площадь всех распыливающих элементов контактной камеры барботажного типа f общ находится из соотношения
f общ = 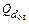 / C w, (3.49)
/ C w, (3.49)
где d оз – требуемая доза озона, г/м3 (определяется экспериментально); С – концентрация озона в смеси, г/м3; ω – интенсивность распыления на единицу площади пористых распылителей, м3/(м2 · ч).
Число распыливающих элементов при площади одного элемента f э
n = f общ / f э. (3.50)
Металлокерамические распылительные трубы по дну контактных камер расположены на расстоянии 0,4 м, а керамические – на расстоянии 0,5 м.
Общий объем камеры
V = k пр Q τ, (3.51)
где k пр – коэффициент увеличения объема вследствие продувки озоновоздушной смеси (k пр = 1,1); τ – время пребывания воды в камере, ч.
Необходимое количество озона находят из соотношения
D оз = d оз Q. (3.52)
Число озонаторов
n = kD оз / q оз, (3.53)
где k – коэффициент запаса (k = 1,05…1,1); q оз – производительность одного озонатора, кг/ч.
Гидравлический эмульсатор (рис. 3.11) представляет собой водяной насос – инжектор. При производительности по воде 50 тыс.м3/сут применяют механические смесители (рис. 3.12). При расчете их время контакта для легко взаимодействующих с озоном веществ принимают равным 0,25-1 мин, а для трудно взаимодействующих – 3 мин.
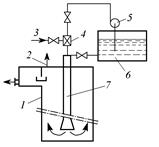 Рис. 3.11. Схема введения озона с применением эмульсатора: 1 – колонна; 2 – отвод непрореагировавшего озона; 3 – подвод озоновоздушной смеси; 4 – эмульсатор; 5 – насос; 6 – емкость; 7 – труба-смеси-тель Рис. 3.11. Схема введения озона с применением эмульсатора: 1 – колонна; 2 – отвод непрореагировавшего озона; 3 – подвод озоновоздушной смеси; 4 – эмульсатор; 5 – насос; 6 – емкость; 7 – труба-смеси-тель | 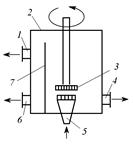 Рис. 3.12. Механический смеситель турбинного типа: 1 – аварийный перелив воды; 2 – корпус; 3 – турбина; 4 – подвод сточной воды; 5 – подвод озоновоздушной смеси; 6 – отвод озонированной воды; 7 – перегородка Рис. 3.12. Механический смеситель турбинного типа: 1 – аварийный перелив воды; 2 – корпус; 3 – турбина; 4 – подвод сточной воды; 5 – подвод озоновоздушной смеси; 6 – отвод озонированной воды; 7 – перегородка |
Обработка сточной воды состоит из двух процессов: растворения озона в воде и химического взаимодействия с окисляемыми веществами. Таким образом, озонирование представляет собой процесс абсорбции, сопровождаемый необратимой химической реакцией в жидкой фазе.
Окисление кислородом воздуха. Кислород используется для очистки сточных вод целлюлозных, нефтеперерабатывающих и нефтехимических заводов. Окисление гидросульфидной и сульфидной серы протекает через ряд последовательных стадий:
S2- → S → SnO6 → 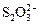 →
→ 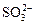 →
→ 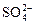 . (3.54)
. (3.54)
Метилмеркаптан в водных растворах под действием кислорода воздуха также окисляется постадийно:
CH3SH → CH3SSCH3 → CH3SO2H → CH3SO3H. (3.55)
Рассмотрим основные химические реакции, протекающие при очистке серосодержащих сточных вод с использованием кислорода воздуха на примере обезвреживания сточных вод выпарной станции целлюлозного завода. Процесс ведут при рН = = 7-7,5. При этом протекают следующие реакции:
2H2S + 2O2 → 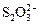 + H2O + 2H+, (3.56)
+ H2O + 2H+, (3.56)
8H2S + 9O2 → 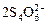 + 6H2O + 4H+, (3.57)
+ 6H2O + 4H+, (3.57)
H2S + 2O2 → 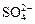 + 2H+, (3.58)
+ 2H+, (3.58)
2HS- + 2O2 → 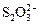 + H2O, (3.59)
+ H2O, (3.59)
2HS- + 4O2 → 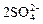 +2H+. (3.60)
+2H+. (3.60)
Окисление кислородом воздуха (рис. 3.13) может быть использовано для очистки от железа как природных, так и производственных сточных вод.
При аэрировании происходит окисление двухвалентного железа в трехвалентное по следующей суммарной реакции:
4Fe2+ + O2 + 10H2O → 4Fe(OH)3↓ + 8H+. (3.61)
Если железо присутствует в воде в виде бикарбоната железа (II), то реакция окисления двухвалентного железа и гидролиз протекают в соответствии со следующим уравнением:
4Fe(HCO3)2 + O2 + 2H2O → 4Fe(OH)3↓ + 8CO2↑. (3.62)
Вместо кислорода воздуха для перевода Fe2+ в Fe3+ можно использовать и другие окислители, например хлор и перманганат калия.
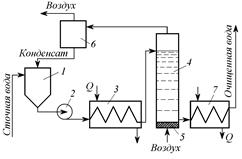
Рис. 3.13. Схема установки окисления сульфидов кислородом воздуха:
1 – приемный резервуар; 2 – насос; 3 – теплообменник; 4 – окислительная колонна; 5 – воздухораспределительное устройство; 6 – сепаратор; 7 – холодильник
Окисление пероксидом водорода. Пероксид водорода используют для окисления нитритов, альдегидов, фенолов, серосодержащих отходов, активных красителей, а также цианидов.
Основная химическая реакция, протекающая при окислении цианидов Н2О2 :
CN- + H2O2 → CNO- + H2O. (3.63)
Например, цианид натрия окисляется пероксидом водорода по схеме
NaCN + 2H2O2 → NaCNO +H2O. (3.64)
Оптимальное значение рН для этих реакций – 10-11. Комплексные цианиды окисляются пероксидом водорода быстрее и легче простых цианидов. Окисление цианидов каталитически ускоряется в присутствии соединений меди.
Используя катализаторы (Fe2+, Cu2+, Mn2+, Co2+, Cr2+, Ag+), можно также ускорить процессы окисления перечисленных органических веществ пероксидом водорода.
 2015-06-10
2015-06-10 3687
3687
