Сточные воды наиболее часто загрязнены минеральными кислотами: серной H2SO4, азотной HNO3, соляной HCl, а также их смесями. Значительно реже в сточных водах встречаются азотистая HNO2, фосфорная H3PO4, сернистая H2SO3, сероводородная H2S, плавиковая HF, хромовая H2СrO4 кислоты, а также органические кислоты: уксусная CH3COOH, пикриновая HOC6H2(NO2)3, угольная H2CO3, салициловая C6H4(OH)2 и др.
Сточные воды, содержащие минеральные кислоты или щелочи, перед сбросом их в водоемы или перед использованием в технологических процессах нейтрализуют. Практически нейтральными считаются воды, имеющие рН = 6,5-8,5.
Применяют следующие способы нейтрализации:
1) взаимная нейтрализация кислых и щелочных сточных вод смешением;
2) нейтрализация реагентами [растворы кислот, негашеная известь CaO, гашеная известь Ca(OH)2, кальцинированная сода Na2CO3, каустическая сода NaOH, аммиак NH4(ОH)];
3) фильтрование через нейтрализующие материалы: известь, известняк CaCO3, доломит CaCO3 · MgCO3, магнезит MgCO3, обожженный магнезит MgO, мел CaCO3 (96-99 %);
4) нейтрализация дымовыми газами.
В зависимости от исходных данных по таблице 3.1 можно ориентировочно назначить способ нейтрализации кислых вод.
Таблица 3.1
Условия применения способов нейтрализации кислых сточных вод
| Кислота, содержащаяся в сточных водах | Концентрация кислоты, г/л | Режим приток | Способ нейтрализации | |||||
| смешением со щелочными сточными водами | раствором | фильтрованием через | ||||||
| извести | известняка | известняк | доломит | мел | ||||
| Серная | <1,5 >1,5 <1,5 >1,5 | Равномерный Неравномерный | + + + + | + + | - - | - - - - | + - + - | + - + - |
| Соляная и азотная | - | Равномерный Неравномерный | + + | + | + | + + | + + | + + |
| Углекислота и др. слабые кислоты | - | Равномерный Неравномерный | + + | + | - - | - - | - - | - - |
Условные обозначения: «+» – применение способа рекомендуется; «0» – применение способа допускается; «-» – применение способа не рекомендуется.
Предложен также способ нейтрализации щелочных сточных вод дымовыми газами. Применение отходящих газов, содержащих CO2 , SO2 , NO2 и другие соединения, позволяет одновременно нейтрализовать сточные воды и производить очистку газов от вредных компонентов.
Нейтрализация сточных вод путем смешения кислых сточных вод со щелочными. Режимы сброса сточных вод, содержащих кислоту и отработанную щелочь, как правило, различны. Кислые воды сбрасываются в канализацию относительно равномерно в течение суток и имеют постоянную концентрацию; щелочные воды сбрасываются периодически по мере того как сбрасывается щелочной раствор. В связи с этим для щелочных вод часто необходимо устраивать регулирующий резервуар. Кислые и щелочные воды смешивают в емкости (рис. 3.1) с мешалкой и без мешалки. В последнем случае перемешивание ведут воздухом при его скорости в линии подачи до 20 м/с. При расчете барботеров расход воздуха на 1 м2 свободной поверхности можно принимать равным, м3/мин: для слабого перемешивания – 0,4, для среднего – 0,8, для интенсивного – 1.
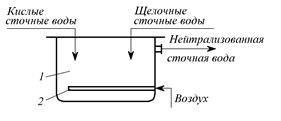
Рис. 3.1. Нейтрализатор смешения:
1 – емкость; 2 – распределитель воздуха (барботер)
Нейтрализация сточных вод реагентами. Для нейтрализации кислых вод могут быть использованы: NaOH, KOH, Na2CO3 , NH4OH (аммиачная вода), CaCO3 , MgCO3 , цемент, доломит (CaCO3 · MgCO3). Однако наиболее дешевым является гидроксид кальция (известковое молоко) с массовой долей активной извести Ca(OH)2 5-10 %. При гашении извести происходит ее гидратация с выделением теплоты:
СаО + H2O = Ca(OH)2 + 67 кДж.
Соду и гидроксид натрия следует использовать, если они являются отходами производства. Иногда для нейтрализации применяют различные отходы производства. Например, шлаки сталеплавильного, феррохромового и доменного производств используют для нейтрализации вод, содержащих серную кислоту.
Реагенты выбирают в зависимости от состава и концентрации кислой сточной воды. При этом учитывают, будет ли в процессе образовываться осадок или нет. Различают три вида кислотосодержащих сточных вод: 1) воды, содержащие слабые кислоты (H2CO3, CH3COOH); 2) воды, содержащие сильные кислоты (HCl, HNO3), для нейтрализации которых могут быть использованы любые названные выше реагенты (соли этих кислот хорошо растворимы в воде); 3) воды, содержащие серную и сернистую кислоты (кальциевые соли этих кислот плохо растворимы в воде и выпадают в осадок).
Известь для нейтрализации вводят в сточную воду в виде гидроксида кальция – известкового молока («мокрое» дозирование) или в виде сухого порошка («сухое» дозирование).
При нейтрализации производственных сточных вод, содержащих серную кислоту, реакция в зависимости от применяемого реагента протекает по уравнениям
H2SO4 + Ca(OH)2 = CaSO4 + 2H2O;
H2SO4 + CaCO3 = CaSO4 + H2O + CO2.
Образующийся в результате нейтрализации сульфат кальция (гипс) кристаллизуется из разбавленных растворов в виде CaSO4 · 2H2O. Растворимость этой соли при температуре 0-40 оС колеблется от 1,76 до 2,11 г/л. Существенным недостатком метода нейтрализации серной кислоты известью является образование пересыщенного раствора гипса (коэффициент пересыщения может достигать 4-6), выделение которого из сточной воды может продолжаться несколько суток, что приводит к зарастанию трубопроводов и аппаратуры. Для уменьшения зарастания трубопроводов применяют методы промывки, увеличивают скорость транспортирования, а также заменяют металлические трубопроводы на пластмассовые.
Для нейтрализации органических жирных кислот применяют известь, содержащую не менее 25-30 % активного оксида кальция или смесь извести с 25 % -й технической аммиачной водой.
Доза реагента для обработки сточных вод определяется из условия полной нейтрализации содержащихся в них кислот или щелочей и принимается на 10 % больше расчетной (табл. 3.2).
Таблица 3.2
Расход реагентов, кг/кг, для нейтрализации 100 % -х кислот и щелочей
| Щелочь | Кислота | |||
| серная | соляная | азотная | уксусная | |
| Известь негашеная гашеная | 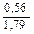 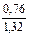 | 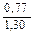 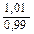 | 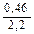 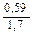 | 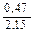 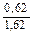 |
| Сода кальцинированная каустическая | 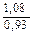 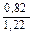 | 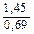 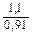 | 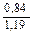 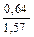 | 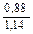 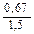 |
| Аммиак | 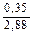 | 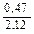 | 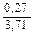 | - |
Примечание. Над чертой указан расход щелочи, под чертой – расход кислоты.
Поскольку в кислых и щелочных производственных сточных водах практически всегда присутствуют ионы металлов, то дозу регента следует определять с учетом выделения в осадок солей тяжелых металлов (табл. 3.3).
Таблица 3.3
Расход реагентов, кг/кг, требуемых для удаления металлов
| Металл | Реагент | |||
| CaO | Ca(OH)2 | Na2CO3 | NaOH | |
| Цинк | 0,85 | 1,13 | 1,6 | 1,22 |
| Никель | 0,95 | 1,26 | 1,8 | 1,36 |
| Медь | 0,88 | 1,16 | 1,66 | 1,26 |
| Железо | 1,32 | 1,9 | 1,43 | |
| Свинец | 0,27 | 0,36 | 0,51 | 0,38 |
Количество реагентов G, кг/ч, для нейтрализации сточных вод определяется по формуле
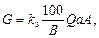 (3.1)
(3.1)
где k з – коэффициент запаса расхода реагента по сравнению с теоретическим, равный для известкового молока 1,1, для известкового теста и сухой извести 1,5; В – количество активной части в товарном продукте, %; Q – расход сточных вод, подлежащих нейтрализации, м3; а – расход реагента для нейтрализации, кг/кг (табл. 3.2); A – концентрация кислоты или щелочи, кг/м3.
При нейтрализации кислых сточных вод, содержащих соли тяжелых металлов, количество реагентов G, кг/ч:
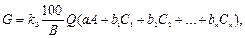 (3.2)
(3.2)
где С 1 , С 2 , …, Сn – концентрации металлов в сточных водах, кг/м3; b 1 , b 2 , …, bn – расход реагентов, требуемых для перевода металлов из растворенного состояния в осадок, кг/кг (табл. 3.3).
Объем осадка V oc, %, образующегося при нейтрализации 1 м3 сточной воды, можно найти по уравнению
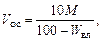 (3.3)
(3.3)
где W вл – влажность осадка, %.
Значения рН, соответствующие началу и окончанию осаждения гидроксидов цветных металлов и железа, представлены в табл. 3.4.
В многокомпонентных сточных водах значения рН, соответствующие началу и окончанию осаждения гидроксидов, существенно сдвинуты в сторону больших значений.
Следует указать, что ионы тяжелых цветных металлов могут осаждаться не только в виде гидроксидов, но и гидроксо-карбонатов (в случае использования для осаждения реагентов, содержащих в своем составе карбонатные ионы). Например:
2ZnCl2 + 2Na2CO3 + H2O → 4 NaCl + CO2 + (ZnOH)2CO3↓ (3.4)
2Cu + 2OH- + 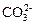 → (CuOH)2CO3↓ (3.5)
→ (CuOH)2CO3↓ (3.5)
2Ni2+ + 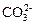 + 2OH- → (NiOH)2CO3↓ (3.6)
+ 2OH- → (NiOH)2CO3↓ (3.6)
2Pb + 2OH- + 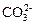 → (PbOH)2CO3↓ (3.7)
→ (PbOH)2CO3↓ (3.7)
Таблица 3.4
Значения рН осаждения гидроксидов металлов
| Катион | Начало осаждения при исходной кон-центрации осаждаемого иона 0,01 моль/л | Полное осаждение |
| Fe2+ Fe3+ Zn2+ Cr3+ Ni2+ Al3+ Cd2+ | 7,5 2,3 6,4 4,9 7,7 4,0 8,2 | 9,7 4,1 8,0 6,8 9,5 5,2 9,7 |
Примечание. Значение рН полного осаждения соответствует остаточной концентрации иона металла 10-5 моль/л.
Кроме того, возможно образование и труднорастворимых карбонатов тяжелых цветных металлов:
Ni2+ + 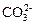 → NiCO3↓ (3.8)
→ NiCO3↓ (3.8)
Pb + 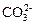 → PbCO3↓ (3.9)
→ PbCO3↓ (3.9)
Гидроксиды цинка, свинца, меди, алюминия и некоторых других металлов растворяются в избытке едкой щелочи с образованием комплексных анионов. Значение рН, соответствующее началу растворения гидроксидов (по Д.Н. Смирнову и В.Е. Генкину):
| Гидроксид | Al(OH)3 | Cr(OH)3 | Zn(OH)2 |
| Значение рН, соответствующее началу растворения гидроксида | 7,8 | 12,0 | 10,5 |
Цинк, алюминий и некоторые другие металлы, обладающие амфотерными свойствами, могут содержаться в виде анионов в щелочных сточных водах. Для их удаления используют растворы кислот. При этом образуются осадки гидроксидов этих металлов согласно следующим уравнениям:
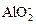 + Н+ + Н2О → Al(OH)3↓ (3.10)
+ Н+ + Н2О → Al(OH)3↓ (3.10)
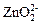 + 2Н+ → Zn(OH)2↓ (3.11)
+ 2Н+ → Zn(OH)2↓ (3.11)
Необходимо указать, что эффективнее совместное осаждение ионов двух или нескольких металлов при одном и том же значении рН, чем при осаждении каждого металла в отдельности.
Это связано с образованием смешанных кристаллов и адсорбционными процессами на их поверхности.
При обработке щелочными реагентами сточных вод, содержащих ионы тяжелых цветных металлов, достигается снижение их концентрации до значений, позволяющих осуществлять сброс очищенной воды в городскую канализацию или водоемы санитарно-бытового пользования.
В том случае, когда требуется более глубокая степень очистки, тяжелые металлы рекомендуется выделять в виде сульфидов. Обычно в виде сульфидов выделяют Cu, Co, Ni, Fe, Sn, Mo, As, Sb, Hg, Ag, Zn, Cd, Pb. Для двухвалентного катиона металла реакция образования сульфида может быть записана в следующем виде:
Ме2+ + S2- → MeS↓ (3.12)
В качестве осадителя обычно используют Na2S (реже – (NH4)2S).
Общая технологическая схема очистки сточных вод от ионов тяжелых металлов представлена на рис. 3.2.
К преимуществам реагентного метода следует отнести высокую степень очистки от тяжелых металлов (до ПДК), а также простоту эксплуатации оборудования. Основные недостатки метода – это образование значительного количества трудноперерабатываемого шлама, а также существенный расход реагентов и связанная с этим необходимость организации реагентного хозяйства. Кроме того, очищенная этим методом вода содержит значительное количество солей и может быть использована в оборотных системах водоснабжения лишь после дополнительной очистки.
Гашение извести производят в колонном аппарате (рис. 3.3). В цилиндрическую колонну 1 через нижний штуцер непрерывно поступает жидкость, которая фильтруется сквозь слой движущегося сверху вниз материала. Раствор необходимой концентрации из расширенной части 2 колонны, которая играет роль сепаратора, через боковой штуцер покидает аппарат для дальнейшей переработки.
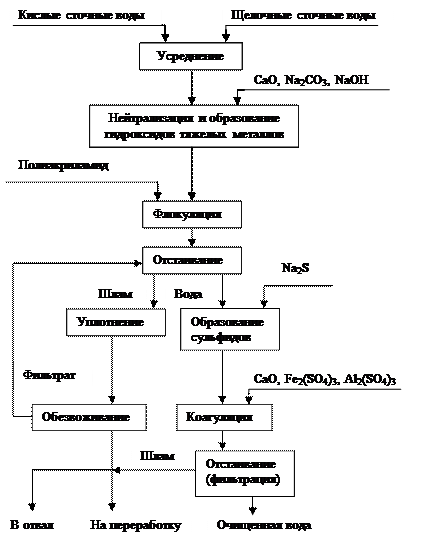 |
Рис. 3.2. Технологическая схема реагентной очистки сточных вод от ионов тяжелых металлов
Исходный твердый дисперсный материал непрерывно подают через загрузочную трубу, нерастворенный остаток выводят снизу. Аппарат может работать как в режиме плотного движущегося слоя, так и в режиме псевдоожиженного слоя. Отличительными его особенностями являются высокая объемная производительность, а также простота устройства.
При приготовлении рабочего раствора известкового молока допустимо перемешивание раствора воздухом с интенсивностью аэрации 0,8 м3/(м2 · мин), возможно также гидравлическое перемешивание с помощью насосов из бака вместимостью 1-4 м3.
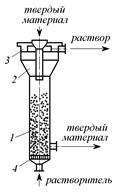 Рис. 3.3. Колонный аппарат для растворения: 1 – колонна; 2 – сепаратор; 3 – кольцевой желоб; 4 – распределительная решетка Рис. 3.3. Колонный аппарат для растворения: 1 – колонна; 2 – сепаратор; 3 – кольцевой желоб; 4 – распределительная решетка |
Для дозирования сухих порошкообразных реагентов используют дозаторы, применяемые в других отраслях промышленности (строительных материалов, химической и др.).
Для отстаивания получающихся в результате нейтрализации осадков применяют отстойники, рассчитанные на пребывание в них сточной воды не менее 2 ч для доведения pH до 7,5-8,5.
Обезвоживание осадка на вакуум-фильтрах предусматривается при количестве сухого вещества в нем не менее 25 кг/м3.
При расчете нагрузку на вакуум-фильтр следует принимать 15-25 кг/(м2 · ч), частоту вращения барабана 0,4 мин-1, поддерживаемый вакуум 53-80 кПа; в качестве фильтрующей ткани применяют капрон и бельтинг.
 2015-06-10
2015-06-10 9924
9924
