Білкова природа ферментів. Білкова природа ферментів в даний час повністю встановлена. Всі ферменти є простими або складними білками. Наприклад, до простих білків відносяться. ферменти трипсин, уреаза й ін., до складних – каталаза, ферменти, що каталізують окисно-відновні процеси й ін. Усі ферменти добре розчиняються у воді, в розбавлених розчинах кислот, лугів, солей і деяких органічних розчинниках. Водні розчини ферментів проявляють типові ознаки ліофільних колоїдних систем. Для ферментів характерна висока молекулярна маса: від десятка тисяч до декількох мільйонів. Понад 400 ферментів отримано в кристалічному вигляді (рис. 1). Всі вони амфотерні і володіють високою хімічною активністю.

Рис. 1. Кристали фосфоенолпіруваткінази
Термолабільність і температурний оптимум дії ферментів. Ферменти – термолабільні сполуки. При дії високих температур вони денатуруються, що призводить спочатку до зменшення, а потім і до припинення каталітичних функцій. Температурний оптимум дії більшості ферментів тварин знаходиться в межах температури тіла – 37 – 40°С. Виключенням є папаїн, найбільша активність каталітичної дії якого виявляється при 80°С, і каталаза, температурний оптимум дії якої лежить між 0 і 10°С. При підвищенні температури середовища на 10°С швидкість реакції зростає в 1,5 – 3 рази (правило ле Шательє) приблизно в межах від 0 до 25°С; потім поволі підвищується і після 40°С починає зменшуватися (рис. 2). При температурі 80 – 100°С ферменти втрачають свою каталітичну здатність, оскільки наступає денатурація білкової молекули. Ферменти в розчиненому стані більш чутливі до нагрівання, ніж в сухому. Відомі ферменти, які можуть короткочасно переносити температуру +100°С (аденілаткіназа). З пониженням температури швидкість ферментативних реакцій поступово зменшується, досягаючи мінімуму при 0°С. Деякі ферменти в сухому стані витримують охолоджування до –120–190°С. При поступовому підвищенні температури до +37°С їх активність відновлюється. Ця властивість використовується при зберіганні сперми для штучного запліднення тварин.
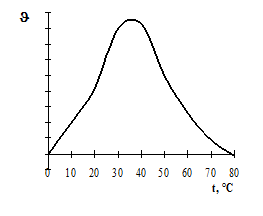
Рис. 2. Залежність швидкості ферментативної реакції від температури
Вплив реакції середовища на активність ферментів. Кожний фермент проявляє максимальну для нього каталітичну дію при певному значенні рН, яке називається рН-оптимумом. Так, для пепсину рН-оптимум рівний 1,5 – 2,5, катепсина – 4,5 – 5,0, карбоксилази – 4,8, уреази – 7,2 – 8,0, трипсину – 7,5 – 9,5 і т.д (табл 1).
Таблиця 1.
 2015-06-26
2015-06-26 597
597








