Це ферменти, що каталізують реакції розщеплення (іноді і синтезу) органічних речовин, за участю води:
R1R2 + HOH «R1H + R2OH
Гідролази широко поширені в природі. Вони беруть участь в обміні нуклеїнових кислот, білків, ліпідів, вуглеводів та інших сполук. Більшість гідролаз – прості білки. Каталітична активність залежить від наявності в їх каталітичних центрах SH-груп. Відомо близько 200 гідролаз. За типом зв’язку який вони гідролізують їх ділять на одинадцять підкласів.
3.1. Гідролази, які діють на складноефірні зв’язки. За тривіальною номенклатурою їх називають естеразами. Підклас складається з шести підпідкласів: гідролази ефірів карбонових кислот, тіолових ефірів, фосфомоноефірів, фосфодиефірів, трифосфомоноефірів і сульфоефірів. В організмі широко поширена ліпаза (гідролаза ефірів гліцерину, КФ 3.1.1.3), особливо в тканинах підшлункової залози. Під її впливом, у тому числі і в тонкій кишці, відбувається розщеплення нейтральних жирів:
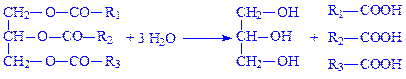
Гідролази тіолових ефірів розщеплюють складні ефіри, утворені SH-групами і карбоновими кислотами. Так, ацетил-КоА-гідролаза (ацетил-КоА – гідролаза, КФ 3.1.2,1) каталізує розкладання ацетил-КоА:
Ацетил-КоА + H2O = KoA + CH3–COOH
Під впливом гідролаз фосфомоноефірів (фосфатаз) фосфорні ефіри розщеплюються на спирти і фосфорну кислоту. Так, лужна фосфатаза (фосфогідролаза моноефірів ортофосфата, КФ 3.1.3.1) каталізує реакцію:
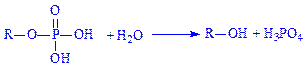
3.2. Гідролази, які діють на глікозильні сполуки. За тривіальною номенклатурою цей підклас називають глікозидазами, оскільки вони розщеплюють глікозидні зв’язки між залишками моноз. Підклас складається з трьох підпідкласів: гідролази глікозидів, N-глікозильних і S-глікозильних сполук. Сюди входять такі ферменти вуглеводного обміну, як a- і b-амілази, целюлаза, інулаза, a- і b-глюкозидази, нуклеозидаза та ін. Типовим представником першого підпідкласу є a-амілаза (a-1,4-глюкан – 4-глюканогідролаза, КФ 3.2.1.1), яка здійснює за присутності іонів Ca2+ гідролітичне розщеплення a-1,4-глюканових зв’язків в полісахаридах. Механізм дії ферментів другого підпідкласа відображає НАД(Ф)-нуклеозидаза (НАД(Ф) – глікогідролаза, КФ 3.2.2.6):
НАД(Ф) + H2O = Нікотінамід + R(Ф)
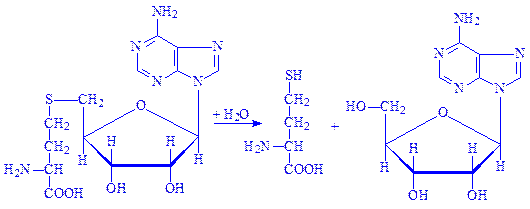
3.3. Гідролази, які діють на прості ефірні зв’язки. Представником ферментів цього підкласу є аденозилгомоцистеїназа (S-аденозил-L-гомоцистеїн гідролаза, КФ 3.3.1.1):
3.4. Пептидгідродази. Вони каталізують розщеплення пептидних зв’язків в білках:
R1–NH–CO–R2 + H2O «R1–NH2 + R2–COOH
Підклас складається з чотирьох підпідкласів: a-амінопептид-аміноацидогідролази, a-карбоксипептид-аміноацидогідролази дипептидгідролази і пептид-пептидогідролази. В підклас входять багато відомих ферментів. Так, амінотрипептидаза (КФ 3.4.1.3) гідролізує пептиди, що містять нейтральні амінокислоти, з відщепленням N-кінцевого залишку молекули; карбоксипептидаза А (КФ 3.4.2.1) гідролізує пептиди з відщепленням С-кінцевого залишку молекули; пепсин (КФ 3,4.4.1) гідролізує зв’язки між залишками ароматичних або дикарбонових L-амінокислот; катепсин С (КФ 3.4.4.1) гідролізує пептиди, особливо по зв’язках, що містять залишок ароматичної амінокислоти, суміжної з вільною a-аміногрупою і т.д.
3.5. Гідролази, які діють на С–N-зв’язки, відмінні від пептидних. Ці ферменти діють на аміни і амідини. Діляться на п’ять підпідкласів. Наприклад, уреаза (карбамід – амідогідролаза, КФ 3.5.1.5) бактерійного походження:
NH2–CO–NH2 + H2O = CO2 + 2NH3
В м’язовій тканині міститься АДФ-дезаміназа (АДФ – аміногідролаза, КФ 3.5.4.7), яка каталізує дезамінування АДФ:
АДФ + H2O = ІДФ + NH3
3.6. Гідролази, які діють на кислотоангідридні зв’язки. Підклас складається з семи підпідкласів. До нього відносяться фосфогідролази, що каталізують розщеплення ангідридів фосфорної кислоти. Зокрема, АТФ-аза (АТФ – фосфогідролаза КФ 3.6.1.3) каталізує реакцію:
АТФ + H2O = АДФ + Н3РО4
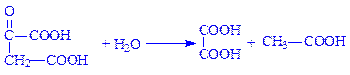
3.7. Гідролази, які діють на С–С-зв’язки. Вони гідролізують зв’язки в основному у кетосполуках. Сюди належить оксалоацетаза (оксалоацетат – ацетилгідролаза, КФ 3.7.1.1). вона розщеплює оксалоацетат:
До інших підкласів гідролаз належать ферменти, що діють на галоїдні зв’язки (3.8), фосфор-азотні зв’язки (3.9), сірка-азотні зв’язки (3.10), і вуглець-фосфорні зв’язки (3.11), які мають важливе значення в обміні багатьох сполук в організмах.
Ліази
Ліази – це ферменти, що каталізують реакції негідролітичного відщеплення певних груп від субстратів з утворенням подвійних зв’язків або реакції приєднання цих груп по подвійних зв’язках. Деякі ліази, на відміну від лігаз, здійснюють реакції синтезу окремих речовин без участі макроергічних сполук. Більшість ліаз – складні білки, що містять в молекулах фосфорні ефіри водорозчинних вітамінів. Клас складається з шести підкласів: вуглець-вуглець-ліази, вуглець-кисень-ліази, вуглець-азот-ліази, вуглець-сірка-ліази і вуглець-галоїд-ліази та ін.
4.1. Вуглець-вуглець-ліази. Ферменти, які здійснюють в основному розрив С–С-зв’язків. В підклас входять три підпідкласи: карбокси-ліази, альдегід-ліази і ліази кетокислот. Типовим представником є піруватдекарбоксилаза (карбокси-ліаза 2-оксокислот, КФ 4.1.1.1), яка здійснює декарбоксилування:
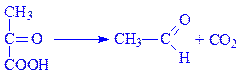
4.2. Вуглець-кисень-ліази. Їх часто називають гідроліазами, або дегідратазами (гідратазами). Самим вивченим ферментом підкласу є карбонат-дегідратаза, або карбоангідраза (карбонат – гідро-ліаза, КФ 4.2.1.1), що каталізує реакцію:
H2CO3 = CO2 + H2O
4.3. Вуглець-азот-ліази. Це ферменти, які здійснюють відщеплення від певних субстратів аміаку або амідинових груп. Наприклад, аспартат – аміак-ліаза (L-аспартат –аміак-ліаза, КФ 4.3.1.1) дезамінує аспартат:
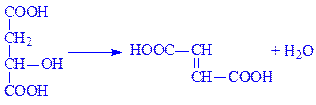
Фермент аргініносукцинат-ліаза (L-аргініносукцинат – аргінін-ліаза, КФ 4.3.2.1) розкладає аргінінянтарну кислоту:
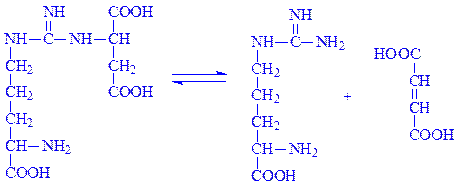
4.4. Вуглець-сірка-ліази. Це ферменти, за допомогою яких розщеплюється зв’язок між вуглецем і сіркою. Прикладом є цистеїндесульфгідраза (L-цистеїн:сірководень-ліаза (дезамінуюча), КФ 4.4.1.1), що каталізує реакцію:
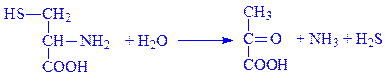
До інших підкласів ліаз належать також вуглець-галоїд-ліази (4.5) і фосфор-кисень-ліази (4.6). Із інших ліаз (4.99) відомий такий фермент, як феррохелатаза (4.99.1.1), що каталізує включення заліза в молекулу гема.
 2015-06-26
2015-06-26 806
806








