Ці ферменти каталізують реакції внутрішньомолекулярного переміщення різних груп органічних речовин. Складаються з п’яти підкласів.
5.1. Рацемази і епімерази. Каталізують реакції інверсії асиметричних груп в молекулах різних речовин. Розрізняють чотири підпідкласи: рацемази і епімерази амінокислот і їх похідних, оксикислот і їх похідних, вуглеводів і їх похідних і інших сполук. Ферменти, що здійснюють реакції ізомеризації в субстратах з одним асиметричним атомом, називають рацемазами. До них слід віднести бактерійні ферменти, які перетворюють L-амінокислоти в D-амінокислоти, зокрема аланінрацемазу (аланінрацемаза, КФ 5.1.1.1):

Ферменти, що здійснюють перетворення субстратів з декількома асиметричними атомами вуглецю, називаються епімеразами. Так, УДФ-глюкозоепімераза (УДФ-глюкозо – 4-епімераза, КФ 5.1.3.2) в тканинах молочної залози ізомеризує УДФ-глюкозу в УДФ-галактозу, яка необхідна для біосинтезу лактози (за участі НАД і іонів Mg2+):
УДФ-глюкоза «УДФ-Галактоза
5.2. Цис-транс-ізомерази. Ці ферменти змінюють геометричну конфігурацію органічних сполук, що містять подвійні зв’язки. Зокрема, малеїнатізомераза (малеїнат – цис-транс -ізомераза, КФ 5.2.1.1) здійснює перетворення:

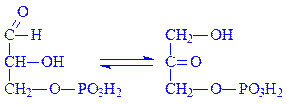
5.3. Внутрішньомолекулярні оксидоредуктази. Ці ферменти каталізують взаємні перетворення альдоз і кетоз. З їх участю окислюються –CH–ОН-групи, одночасно відновлюється сусідня СО-група. Так, тріозофосфатізомераза (D-гліцеральдегід-3-фосфат – кетол-ізомераза, КФ 5.3.1.1) каталізує реакцію:
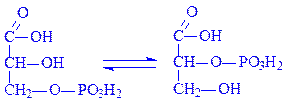
5.4. Внутрішньомолекулярні трансферази. Ці ферменти часто називають мутазами. Вони переносять певні групи з однієї частини молекули на іншу. Так, під впливом фосфогліцерат-фосфомутази (D-фосфогліцерат – 2,3-фосфомутази, КФ 5.4.2.1) відбувається реакція:
5.5. Внутрішньомолекулярні ліази. До ферментів, що каталізують внутрішньомолекулярні перетворення ліазного типу, відноситься муконат-циклоізомераза (4-карбоксиметил-4-оксиізокротонолактон – ліаза (дециклізуюча), КФ 5.5.1.1), що каталізує реакцію:
(+)-4-карбоксиметил-4-окси-ізокротонолактон = Цис-цис -муконат
6. лігази (синтетази)
Ці ферменти каталізують реакції з’єднання двох молекул та реакції спряжені з відщепленням залишків фосфорної кислоти від АТФ або її аналогів. Термін „лігази” застосовують також до ферментів, що каталізують реакції синтезу без нуклеозидтрифосфатів. Вони сприяють утворенню хімічних зв’язків, що власне і є причиною їх назви (від лат. ligare – зв’язувати). Механізм реакцій складний. Він є або трьохстадійним перенесенням, або утворенням потрійних комплексів. Кофакторами багатьох лігаз є біотин і його похідні. Число лігаз, відомих зараз, досягає 100.
6.1. Лігази, які утворюють С–О-зв’язки. До підкласу належать ферменти, що каталізують приєднання амінокислот до відповідних тРНК. Число лігаз відповідає кількості амінокислот, які використовуються для біосинтезу молекул білків. Утворюються аміноацил-тРНК. Так, тирозил-тРНК – синтетаза (L-тирозин: тРНК – лігаза (АМФ), КФ 6.1.1.1) за наявності іонів Mg2+ і K+ каталізує реакцію
АТФ + L-Тирозин + тРНК = АМФ + Пірофосфат + L-Тирозил-тРНК
6.2. Лігази, які утворюють С–S-зв’язки. Ці ферменти здійснюють утворення С–S-зв’язків між залишками жирних кислот і KoA. Зв’язок макроергічний. Активований залишок жирної кислоти залучається до всіляких реакцій синтезу або розщеплення. Так, під впливом ацетил-KoA – синтетази (ацетат: KoA – лігази (АМФ), КФ 6.2.1.1) і за наявності іонів Mg2+ в різних тканинах протікає реакція
АТФ + Ацетат + KoA = АМФ + Пірофосфат + Ацетил-КоА
6.3. Лігази, які утворюють С–N-зв’язки. Підклас складається з п’яти підпідкласів: амідсинтетази, пептидсинтетази, циклолігази, інші С–N-лігази і С–N-лігази з глутаміном в ролі N-донора. Особливе значення мають пептидсинтетази, під впливом яких з амінокислот синтезуються пептиди. Наприклад, g-глутамілцистеїнсинтетаза (L-глутамат:L-цистеїн – лігаза (АДФ), КФ 6.3.2.2) в тканинах печінки за наявності іонів Mg2+ каталізує реакцію утворення дипептида:
АТФ + L-Глутамат + L-Цистеїн = АДФ + Ортофосфат + g-L-глутаміл-L-цистеїн
6.4. Лігази, які утворюють С–С-зв’язки. З цього підкласу найбільш детально вивчена карбоксилаза, що каталізує реакцію карбоксилування. Так, під впливом піруваткарбоксилази (піруват: CO2 – лігази (АДФ), КФ 6.4.1.1) в тканинах за наявності іонів Mg2+ з піровиноградної кислоти і вуглекислого газу утворюється щавелевооцтова кислота:
АТФ + СН3–СО–СООН + СО2 + Н2О = НООС–СН2–СО–СООН + АДФ + Н3РО4
Другий фермент цього підпідкласу ацетил-КоА – карбоксилаза (ацетил-КоА:CO2 – лігаза (АДФ), КФ 6.4.1.2) каталізує утворення з ацетил-КоА і СО2 малоніл-КоА – проміжного продукту біосинтезу вищих жирних кислот:
АТФ + Ацетил-КоА +СО2 + Н2О = АДФ + Ортофосфат + Малоніл-КоА
Класифікація і номенклатура ферментів у ході розвитку біохімії і в результаті відкриття нових ферментів постійно удосконалюються, а їх число з кожним роком збільшується.
 2015-06-26
2015-06-26 619
619








