Рентгеновский уровень - условное изображение внутренней энергии атома, в котором отсутствует один электрон.
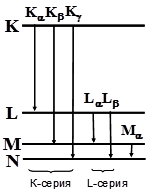 За нулевой рентгеновский уровень принимают энергию атома, из которого удален оптический электрон. Из всего сказанного ясно, что самым высоким следует изображать К-уровень, затем (ниже) L- уровень и т.д.
За нулевой рентгеновский уровень принимают энергию атома, из которого удален оптический электрон. Из всего сказанного ясно, что самым высоким следует изображать К-уровень, затем (ниже) L- уровень и т.д.
Рисунок 1. Упрощенная схема рентгеновских уровней и переходов между ними.
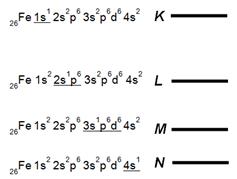
Упрощенная схема рентгеновских уровней атома Fe.
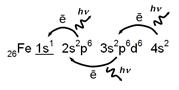
26Fe 1s22s2p63s2p6d64s2 - электронное строение атома железа.
Если путем внешнего воздействия из внутренней оболочки атома удалить один электрон, то произойдет перестройка всех его электронных оболочек. На место выбитого электрона перейдет электрон с более внешней оболочки, а вновь освободившееся место займет еще более внешний электрон и т.д. до тех пор, пока все свободные места во внутренних оболочках не окажутся занятыми.
Каждый переход электрона сопровождается излучением рентгеновского кванта определенной длины волны. Совокупность квантов (фотонов) всех частот (длин волн), которые могут быть испущены атомами данного элемента, составляют рентгеновский спектр испускания этого элемента.
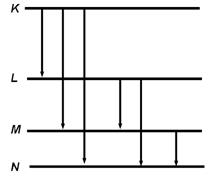
Стрелками, направленными вниз, показаны энергетические переходы атома, благодаря которым появляются линии в рентгеновском спектре.
Как видно из рисунка все линии в спектре распределены по сериям.
Все линии, соответствующие переходам атома с К - уровня составляют К - серию линий, с L - уровня составляют L - серию и т.д.
Линии К- серии расположены в наиболее коротковолновой области спектра. Линию, соответствующую переходу на ближайшей уровень обозначают индексом “ a “, на следующие - индексом “ b “, “ g “ и т.д. Например: линия, соответствующая переходу атома L ® М обозначается “La“, а линия перехода K ® M - “Kb“
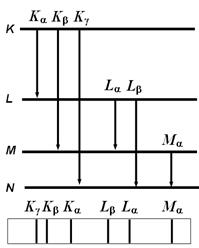 Самой длинноволновой линией данной серии является линия под индексом “a“.
Самой длинноволновой линией данной серии является линия под индексом “a“.
Атомы каждого химического элемента испускают рентгеновское излучение только определенных длин волн.
Набор квантов (фотонов) всех частот (длин волн), которые могут быть испущены атомами данного элемента, составляют рентгеновский спектр испускания этого элемента.
Рентгеновские спектры проще оптических. Одной из особенностей рентгеновских спектров является их однообразие.
При отрыве одного из внутренних электронов, независимо от того, какой он принадлежал оболочке (s, р, d или f), образуется дублетный уровень; при дальнейшей перестройке из каждой оболочки опять уходит по одному электрону, что приводит тоже к дублетному состоянию в любом атоме. Таким образом, рентгеновские уровни, независимо от элемента, имеют дублетную структуру.
Различия же в спектрах разных элементов связаны только с их смещением в коротковолновую область по мере увеличения заряда ядра.
 2015-06-28
2015-06-28 801
801







