По сокращённой электронной формуле … 3d10/ 4s2 4p4 определите химический элемент и прогнозируйте:
а) металл или неметалл?
б) какие кислоты и соли образует этот элемент?
в) какова ковалентность этого элемента в невозбуждённом состоянии и возбуждённом состоянии?
Ответы:
а) это элемент №34 – селен (Se).
p – элемент, неметалл; расположен в 4 периоде VI A группе.
б) Se0 … 4s2 4p4 + 2e - ® Se- 2 … 4s2 4p6
Селен образует селеноводородную кислоту H2+Se-2, её соли ─ селениды, например, Na2Se.
Se0 … 4s2 4p4 – 4e - ® Se+4 … 4s2 4p0
Селен образует оксид SeO2 и соответствующую кислоту:
SeO2 + H2O ® H2SeO3.
Селенистая кислота, её соли – селениты, например, Na2SeO3 ─ селенит натрия.
Se0 … 4s2 4p4 – 6e - ® Se+6 … 4s0 4p0
Селен образует оксид SeO3 и соответствующую кислоту:
SeO3 + H2O ® H2SeO4
Селеновая кислота, её соли – селенаты. H2SeO4 – селенат натрия.
в) ковалентность в невозбуждённом состоянии
Se …4s2 4p4 4d0
| d | |||||||||
| p | |||||||||
| s | ¯ | | | ||||||
| ¯ |
ковалентность Se0 = 2
|
|
|
Это значит, что Se может образовать в соединениях две ковалентные химические связи. Например, H2Se;
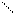 H H
 Se
H Se
H
|
Ковалентность в возбуждённом состоянии:
Se* …4s2 4p3 4d1
| d | |||||||||
| p | | ||||||||
| s | 
| | | ||||||
| ¯ |
ковалентность Se* = 4
Se** …4s1 4p3 4d2
| d | |||||||||
| p | | | |||||||
 s s
| 
| | | ||||||
| |
ковалентность Se** = 6
Это значит, что Se в возбуждённом состоянии может образовать в соединениях 4 или 6 ковалентных связей.
ЛИТЕРАТУРА
1. Химия: Справ. изд. / В.Шретер, К.-Х.Лаутеншлегер, Х.Бибрак и др.: Пер. с нем. – М.:Химия, 1989. 648 с.
2. Глинка Н.Л. Общая химия:Учеб. пособие для вузов /
Под ред. В.А.Рабиновича. Л.: Химия, 1987. 704 с.
ОГЛАВЛЕНИЕ
1.Строение атома……………………………….……….….3
1.1.Ядро и электронная оболочка атома….…….….….3
1.2. Строение ядра атома….……………………………4
1.3. Нуклиды, изотопы, массовое число…..…………..6
1.4. Строение электронной оболочки атома. Энергетические уровни.……………………………….8
2. Квантово-механическое объяснение строения атома………………………………………….……………….8
2.1. Орбитальная модель атома………………………….8
2.2. Орбитали с s,p,d,f-электронами (атомные s,p,d,f –орбитали)……………………………………………13
2.3. Энергетические подуровни многоэлектронного атома. Принципы построения электронной оболочки…………………………………………….15
|
|
|
3. Практическая часть…………………………………….21
Литература……………………………………………………30
 2015-06-24
2015-06-24 498
498







