Электролиты — вещества, обладающие ионной проводимостью. Это растворы солей, кислот, щелочей, а также расплавы солей. Электролиты – проводники второго рода, в которых ток связан с переносом вещества в отличие от металлических проводников.
Ионная проводимость электролитов обусловлена электролитической диссоциацией, т.е. распадом на ионы молекул растворяемого вещества под действием молекул растворителя. Ионы имеют одинаковые по модулю и противоположные по знаку заряды.
Под действием электрического поля ионы в электролите упорядочение движутся: положительные ионы – к отрицательному электроду, а отрицательные – к положительному.
Ток в электролитах представляет собой упорядоченное движение ионов.
Электролизом называется процесс выделения частей химических соединений на электродах при прохождении тока через раствор или расплав этих соединений.
Первый закон Фарадея для электролиза. Масса вещества, выделившегося при электролизе на электроде, пропорциональна заряду q, прошедшему через электролит:
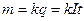
где k – коэффициент пропорциональности, называемый электрохимическим эквивалентом данного вещества.
Электрохимический эквивалент вещества численно равен массе данного вещества, выделившегося из электролита на одном из электродов при прохождении через электролит единицы электрического заряда.
Единица k в SI равна: 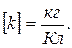
Используется внесистемная единица: 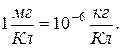
Второй закон Фарадея для электролиза. Электрохимические эквиваленты k различных веществ прямо пропорциональны массам их молей и обратно пропорциональны их валентностям.
Объединенный закон электролиза Фарадея. Масса вещества, выделившегося при электролизе на электроде, пропорциональна атомной А (молярной μ) массе этого вещества, силе тока и времени его прохождения через электролит и обратно пропорциональна валентности вещества:
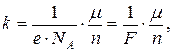
где NA – число Авогадро, е – модуль заряда электрона, 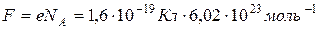 – постоянная Фарадея.
– постоянная Фарадея.
Постоянная Фарадея численно равна электрическому заряду, который нужно пропустить через электролит для выделения на электроде массы любого вещества, равной его химическому эквиваленту.
 2015-06-28
2015-06-28 3166
3166
