Определить число N молекул, содержащихся в объеме V = 1 мм3 воды, и массу m1 молекулы воды. Считая условно, что молекулы воды имеют вид шариков, соприкасающихся друг с другом, найти диаметр d молекулы.
Дано: 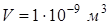 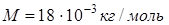 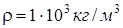 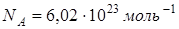 | Решение: Число N молекул, содержащихся в некоторой системе массой m, равно произведению постоянной Авогадро NА на количество вещества v: 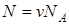 . Так как v = m/M, где М - молярная масса, то . Так как v = m/M, где М - молярная масса, то 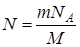 . . |
| N, m1, d -? |
Выразив в этой формуле массу как произведение плотности на объем V, получим:

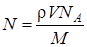 .
.
Произведем вычисления, учитывая, что для воды 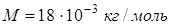 :
:
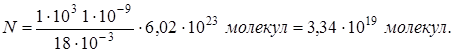
Массу m1 одной молекулы можно найти по формуле
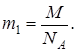 (1)
(1)
Подставив в (1) значения М и NA, найдем массу молекулы воды:
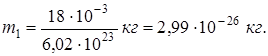
Если молекулы воды плотно прилегают друг к другу, то можно считать, что на каждую молекулу приходится объем (кубической ячейки) V1 = d3, где d – диаметр молекулы. Отсюда
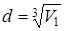 . (2)
. (2)
Объем V1 найдем, разделив молярный объем Vm на число молекул в моле, т.е. на NA :
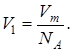 (3)
(3)
Подставим выражение (3) и (2):
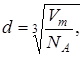
где 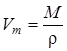 . Тогда
. Тогда 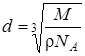 (4)
(4)
Проверим, дает ли правая часть выражения (4) единицу длины:
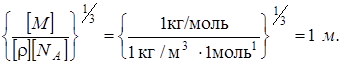
Произведем вычисления:
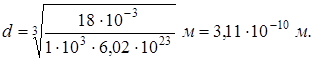
Пример 2.
В баллоне объемом 10 л находится гелий под давлением р1= 1 МПа и при температуре Т1 = 300 К. После того как из баллона было взято m = 10 г гелия, температура в баллоне понизилась до Т2 = 290 К. Определить давление р2 гелия, оставшегося в баллоне.
| Дано: р1= 1·106 Па Т1 = 300 К Т2 = 290 К m = 0,01кг V=1·10-2 м3 | Решение: Для решения задачи воспользуемся уравнением Менделеева – Клапейрона, применив его к конечному состоянию газа: 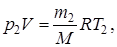 (1) (1) |
| р2 -? |
где m2 – масса гелия в баллоне в конечном состоянии; М – молярная масса гелия; R – молярная газовая постоянная.
Из уравнения (1) выразим искомое давления
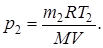 (2)
(2)
Массу m2 гелия выразим через массу m1 , соответствующую начальному состоянию, и массу m гелия, взятого из баллона:
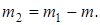 (3)
(3)
Массу m1 гелия найдем также из уравнения Менделеева – Клапейрона, применив его к начальному состоянию газа:
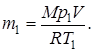 (4)
(4)
Подставив выражение массы m1 в (3), а затем выражение m2 в (2), найдем:
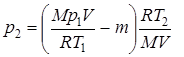 или
или 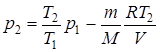 (5)
(5)
Проверим, дает ли формула (5) единицу давления. Для этого в ее правую часть вместо символов величин подставим их единицы. В правой части формулы два слагаемых. Очевидно, что первое из них дает единицу давления, так как состоит из двух множителей, первый из которых (Т2 / Т1) – безразмерный, а второй – давление. Проверим второе слагаемое:
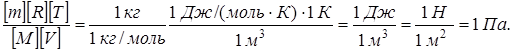
Произведем вычисления по формуле (5), учитывая, что 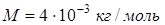 ,
, 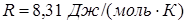 :
:
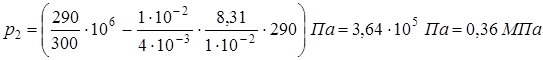 .
.
Пример 3.
Баллон содержит m 1= 80 г кислорода и m 1= 320 г аргона. Давление смеси p = 1 МПа, температура Т = 300 К. Принимая данные газа за идеальные, определить объем V баллона.
| Дано: р= 1·106 Па m1 = 0,08 кг m2 = 0,32 кг T = 300 K | Решение: По закону Дальтона, давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. По уравнению Менделеева – Клапейрона, парциальные давления р1 кислорода и р2 аргона выражаются формулами: |
| V -? |
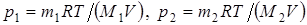 .
.
Следовательно, по закону Дальтона, давление смеси газов
р = р 1 + р 2, или 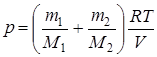 ,
,
Откуда объем баллона
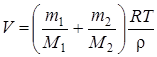 .
.
Произведем вычисления, учитывая, что М 1 = 32·10-3 кг/моль, М 2 = 40·10-3 кг/моль, 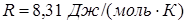 :
:
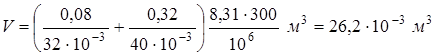 .
.
Пример 4.
Найти среднюю кинетическую энергию 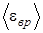 вращательного движения одной молекулы кислорода при температуре Т = 350 К, а также кинетическую энергию Е к вращательного движения всех молекул кислорода массой m = 4 г.
вращательного движения одной молекулы кислорода при температуре Т = 350 К, а также кинетическую энергию Е к вращательного движения всех молекул кислорода массой m = 4 г.
Дано: m = 0,004 кг T = 350 K 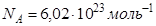 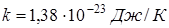 | Решение: На каждую степень свободы молекулы газа приходится одинаковая средняя энергия 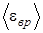 = = 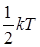 , где k – постоянная Больцмана, Т – термодинамическая температура газа. Так как вращательному движению двух- атомной молекулы (молекула кислорода - , где k – постоянная Больцмана, Т – термодинамическая температура газа. Так как вращательному движению двух- атомной молекулы (молекула кислорода - |
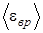 , Е к -? , Е к -? |
двухатомная) соответствует две степени свободы, то средняя энергия вращательного движения молекулы кислорода 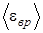 =
= 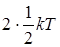 . (1)
. (1)
Кинетическая энергия вращательного движения всех молекул газа 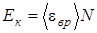 (2)
(2)
Число всех молекул газа
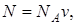 (3)
(3)
где NA – постоянная Авогадро, v – количество вещества.
Если учесть, что количество вещества v = m/M, где m – масса газа, М – молярная масса газа, то формула (3) примет вид
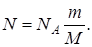
Подставив выражение N в формулу (2), получаем
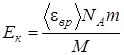 . (4)
. (4)
Произведем вычисления, учитывая, что для кислорода 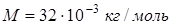 :
:
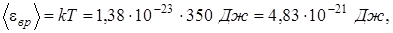
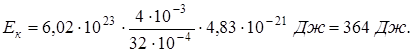
Пример 5.
Вычислить удельные теплоемкости при постоянном давлении сP и постоянном объеме cV неона и водорода, принимая эти газы за идеальные.
Решение:
 2015-06-24
2015-06-24 2125
2125







