Единственная известная биологическая роль витамина К заключается в том, что он является коферментом у-глута-маткарбоксилазы, карбоксилирующей глутаминовую кислоту с образованием у-карбоксиглутаминовой кислоты. Фермент удалось очистить до гомогенного состояния (белковая цепь содержит 758 аминокислот с преобладанием гидрофобных) и определить его структурный ген (он включает 15 экзонов).
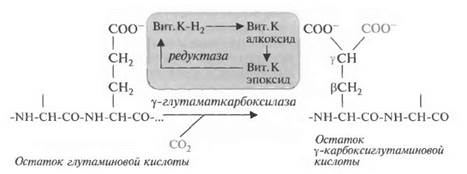
При взаимодействии восстановленной формы витамина К-Н2 с у-глутаматкарбоксилазой в присутствии кислорода образуется сильное основание (алкоксид), способное отнять от у-С атома глутамино-вой кислоты водород, на место которого присоединяется СО2, при этом образуется у-карбоксиглутаминовая кислота. В холе реакции появляются коротко живущие и высоко токсичные промежуточные соединения (свободные радикалы витамина К), которые превращаются в нетоксичный эпоксид витамина К в присутствии тута мата. Эпоксил витамина К снова восстанавливается в витамин К-Н2 с помощью ферментов редуктаз. Следовательно, при дефиците глутаминовой кислоты в клетке затрудняется обезвреживание токсичных свободных радикалов витамина К.
у-карбоксиглутаминовая кислота является Са+*-связывающей аминокислотой, которая необходима для функционирования кальцийсвя-швающих белков. К таковым относятся:
§ факторы свертывающей системы крови — IX, VII, X и протромбин;
§ регуляторные белки (протеин С и протеин S), нуждающиеся в у-карбоксиглутаминовой кислоте для Са-индуцированного взаимодействия с поверхностью клеточной мембраны;
§ белки минерализации костной ткани (костный у-карбоксиглута-миновый протеин и другие); поскольку при дефекте синтеза костного у-карбоксиглутаминового белка кальцифицируются артерии и хряши; возможно, что его функцией является также контроль за внекостной кальцификацией;
§ витамин-К-зависимый белок Gas 6, активирующий рост глад-комышечных клеток; витамин-К-зависимый сократительный белок хвостика сперматозоида;
§ некоторые нейротоксины (например, содержащиеся в яде улитки).
Общей особенностью всех витамин-К-зависимых белков является формирование белковой сеточки, образованной гамма-карбоксилутаминовой кислотой, связанной с кальцием. Такая сеть впервые была описана для протромбина. Протромбин в присутствии Са++ связывается с биомембраной, что является необходимым условием для реализации процесса свертывания крови.
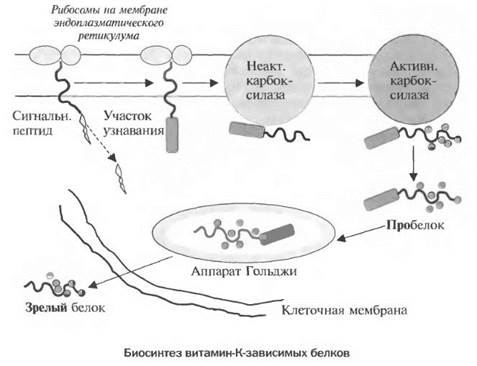
Витамин-К-зависимые белки синтезируются в эндоплазматическом ретикулуме в виде белков-предшественников, содержащих сигнальный участок и «участок узнавания» для гамма-карбоксилирования. После отщепления сигнального пептида белок с помощью «участка узнавания» связывается с витамин-К-зависимой карбоксилазой, локализирующейся в мембранах эндоплазматического ретикулума. В результате этого связывания у-карбоксиглутаматкарбоксилаза переходит из неактивного состояния в активное и начинает осуществлять каталитическое превращение остатка глутаминовой кислоты в у-карбоксиглутаминовую кислоту в витамин-К-зависимом пробелке.
Карбоксилированный яробелок перемешается в сетчатый аппарат Гольджи, где расщепляется, и зрелая белковая молекула секретируется клеткой в межклеточное пространство (см. рис. ниже). На N-конце зрелого протромбина и других К-зависимых белков содержится 10—12 остатков у-карбоксиглутаминовой кислоты. Домены с такими участками высоко структурированы и заключают в себе линейно расположенные ионы кальция.
 2015-06-26
2015-06-26 2279
2279
