ОСНОВНЫЕ ПОНЯТИЯ И ТЕРМИНЫ
Для адекватного восприятия смысла любого текста следует четко определиться со смыслом используемых в нем терминов.
Общенаучные термины
| Научные знания | • это система теорий, представленных ясным, строгим и общепринятым в данное время языком • отражают объективные законы Природы, основой научных знаний являются наблюдение и эксперимент. •практика-критерий истинности и научности знаний. • научные знания позволяют объяснять и предсказывать явления Природы |
| Химия | • наука, изучающая состав, строение, свойства и превращения веществ, а также законы управляющие этими превращениями |
| Гипотеза | • предположительное суждение о закономерной связи явлений, • должна поддаваться проверке, соответствовать результатам наблюдения и экспериментов • не должна быть логически противоречивой |
| Эксперимент | • метод научного познания, при помощи которого в контролируемых и управляемых условиях исследуются явления действительности |
| Закон | • необходимое, существенное, повторяющееся соотношение между явлениями |
| Теория | • высшая форма организации научных знаний, устанавливающая закономерности определенной области реальности |
| Материя | • объективная реальность, существующая вне и независимо от человеческого сознания и отображаемая им |
| Вещество | • форма материи, состоящая из частиц, имеющих массу покоя (молекула, атом, электрон и т.п.) |
| Поле | • форма материи, не имеющая массы покоя (электромагнитное, гравитационное поля и т.п.) |
| Масса, m (г, кг) | • физическая характеристика материи, являющаяся выражением и мерой гравитационных и инерционных свойств материи |
| Взаимосвязь энергии (E) и массы (m) | Е = mc2 |
Основные термины, понятия и законы химии
| Атом | •электронейтральная, химически неизменяемая частица вещества, состоящая из положительно заряженного ядра и взаимодействующих с ним отрицательно заряженных электронов |
| Относительная атомная масса элемента, Ar | •величина, показывающая во сколько раз масса атома данного элемента больше 1/12 массы атома углерода 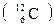 . . |
| Молекула (лат. moles – масса) | • наименьшая электронейтральная частица вещества состоящая из взаимодействующих атомов и определяющая химические свойства данного вещества |
| Относительная молекулярная масса, Mr | •величина, показывающая во сколько раз масса молекулы простого или сложного вещества больше 1/12 массы атома углерода 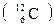 •равна сумме относительных атомных масс всех атомов, входящих в данную молекулу •равна сумме относительных атомных масс всех атомов, входящих в данную молекулу |
| Абсолютная атомная (молекулярная) масса,m0 (г, кг). | • масса одной частицы (атома, молекулы) выраженная в единицах массы |
| Моль, n или ν | •количество вещества, содержащее такое же число структурных единиц (атомов, молекул, ионов, электронов, эквивалентов и т.д.), которое равно числу атомов (постоянная Авогадро) в 12г изотопа углерода 12 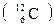 |
| Постоянная Авогадро, NA (моль-1) | 6,02∙1023 |
| Молярная масса, M(г/моль) | •физическая величина, равная массе вещества, взятого количеством 1 моль •численно совпадает со значением относительной атомной или молекулярной массы вещества |
| Молярный объем, Vm (л/моль, м3/моль) | •физическая величина, равная объему вещества, взятого количеством 1 моль. молярный объем газов при нормальных условиях (н.у.) приблизительно равен: Vm ≈ 22,4 л /моль. |
| Взаимосвязь m, ν, M | ● m ν = —— М пример: m (H2SO4)=196г M(H2SO4)=98 г/моль 196г ν(H2SO4) = —— = 2 моль 98г/моль |
| Химический элемент | • определенный вид атомов, имеющих одинаковые значения зарядов ядер, строение которых определяет химическую индивидуальность элемента. • заряд ядра атома (количество протонов) определяет порядковый номер элемента в периодической системе химических элементов. |
| Молекулы простых веществ | • состоят из взаимодействующих между собой атомов одного и того же химического элемента, (H2,O2,N2,O3,P4,S8) |
| Молекулы сложных веществ | • состоят из атомов разных химических элементов, вступивших в химическое взаимодействие между собой (H2O, CO2, HCN) |
| Макромоле-кула | • совокупность большого числа одинаковых повторяющихся группировок атомов, соединенных химическими связями • макромолекула может состоять из тысяч и миллионов атомов |
| Химическая формула | • выражает элементный состав соединения и указывает относительное количество атомов различных элементов в молекуле данного вещества (С2H6, Ca3 (PO4)2, O2 ) |
| Химические знаки (графические символы химических элементов и соединений) | •система сокращенных обозначений химических элементов например: Cu (сuprum – медь), S (sulfur – сера); предложено шведским химиком И.Я. Берцелиусом в 1811г. |
| Химические реакции | • процесс превращения одних веществ в другие, отличающиеся от исходных составом и свойствами |
| Химические уравнения | • запись реакций при помощи химических формул и численных коэффициентов |
| Структурные (графические) формулы | • условное изображение строения молекул химических соединений с учетом геометрического расположения атомов и структуры их связей; например: серная кислота: H O O S H O O, диметиловой эфир: Н Н     H – C – O – C – H H H H – C – O – C – H H H |
| Закон сохранения энергии | • энергия изолированной системы постоянна, не зависит от процессов, происходящих в этой системе |
| Закон сохранения массы при химических реакциях | • сумма масс веществ системы после окончания химической реакции, равна сумме масс исходных веществ |
| Закон постоянства состава | • всякое химически индивидуальное вещество имеет всегда один и тот же количественный и качественный состав независимо от способов и условий его получения; сформулирован Прустом (Франция 1801-1802); применим, в основном, к веществам жидкофазных и газовых систем |
| Эквивалент, Э | •реальная или гипотетическая (условная) частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна одному иону водорода в кислотно-основных реакциях или одному электрону в окислительно-восстановительных реакциях |
| Эквивалентная масса (молярная масса эквивалента), Mэ (г/моль) | • масса эквивалентов, взятых количеством 1 моль 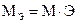 |
| Эквива-лентный объем, Vэ (л/моль) | • объем, занимаемый 1 моль эквивалентов вещества: Vэ (Н2) = 11,2л /моль (н.у.) Vэ (О2) = 5,6л/моль (н.у.) |
| Закон эквивалентов | •массы (объемы) взаимодействующих веществ относятся как их эквивалентные массы (объемы) 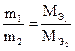 ; ; 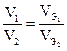 |
| Закон кратных отношений | • если два вещества образуют между собой несколько соединений, то массы этих веществ в разных соединениях относятся как небольшие целые числа Сформулирован английским ученым Дальтоном в 1808 г |
| Закон Дальтона | • парциальное давление газа в смеси - давление которое производил бы этот газ, если бы один занимал объем, равный объему смеси при той же температуре • общее давление смеси газов, не вступающих друг с другом в химическое взаимодействие, равно сумме парциальных давлений газов, составляющих смесь: 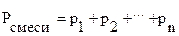 |
| Уравнение Клапейрона ―Менделеева | • m PV = —— RT M 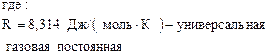 |
| Закон Бойля-Мариота (изотерма) | • при постоянной температуре (T=const) давление, производимое данной массой газа, обратно пропорционально объему газа: p1V1= p2V2 =…= pnVn, т.е. pV = const |
| Гей-Люссака (изобара) | • при постоянном давлении (p=const) объем данной массы газа изменяется прямо пропорционально абсолютной температуре: V1 V2 Vn V — = — = … = ―, т.е. ― = const T1 T2 Tn T |
| Закон Шарля (изохора) | • при постоянном объеме (V=const) давление данной массы газа прямо пропорционально абсолютной температуре: p1 p2 pn p — = — = … = —, т.е. ― = const T1 T2 Tn T |
| Относительная плотность одного газа по другому | • величина, равная отношению плотностей газов, находящихся в одинаковых условиях; pассчитывается как отношение молярных масс газов. ρ1 M1 D(газ1/газ2) = — = — ρ 2 M2 |
| Закон Авогадро Следствие из закона Авогадро | • в равных объемах различных газов при одинаковых значениях температуры и давления содержится одинаковое число молекул • при одинаковых физических условиях 1 моль любого газа занимает один и тот же объем; при нормальных условиях (Т = 273,15 К; р = 101325 Па) молярный объем составляет приблизительно 22,4 ∙ 10-3 м3/моль, или 22,4 м3/кмоль, или 22,4 л/моль |
 2015-06-26
2015-06-26 945
945







