Активаторами называют вещества, которые повышают активность ферментов. Примером таких соединений являются аминокислота цистин и восстановленный глютатион, содержащие свободную –SH-группу. Их активирующее действие заключается в том, что они восстанавливают дисульфидные связи с образованием –SH-групп, необходимых для проявления каталитической активности тиоловых ферментов. Кроме того, некоторые ферменты активируются металлами, которые либо участвуют в построении активного центра, либо стабилизируют пространственную конформацию ферментного белка и тем самым обеспечивают проявление каталитических функций. Активность фермента α-амилазы слюны человека повышается в присутствии анионов Clˉ.
Ингибиторы замедляют скорость биохимических реакций, а в ряде случаев полностью приостанавливают её. Процесс ингибирования может быть обратимым и необратимым. При необратимом ингибировании ингибитор ковалентно связывается с ферментом, необратимо изменяя его нативную конформацию. После удаления ингибитора активность фермента не восстанавливается.
Одним из широко известных типов необратимого ингибирования является действие алкилирующих агентов, образующих прочные ковалентные связи с –SH- группами фермента. Необратимыми ингибиторами также являются цианиды, подавляющие активность ферментов цитохромов, содержащих железо; этилендиаминтетраацетат (ЭДТА), подавляющий действие α-амилазы, за счёт связывания с ионами Ca+2 (кофактора α-амилазы).
При обратимом ингибировании активность фермента восстанавливается после удаления ингибитора. Обратимые ингибиторы бывают конкурентного, неконкурентного, бесконкурентного и смешанного действия.
Первая группа – это близкие аналоги субстратов, содержащие весь набор или, по крайней мере, большую часть групп, узнаваемых активным центром фермента, и поэтому образующие комплекс фермент-ингибитор, сходный с комплексом фермент-субстрат. Однако в силу специфики своей структуры они не подвергаются ферментативному превращению. Занимая активный центр, эти ингибиторы препятствуют связыванию субстрата и тем самым протеканию ферментативной реакции. Они фактически конкурируют с субстратом за взаимодействие с активным центром и поэтому их называют конкурентными ингибиторами. Например, структурные аналоги янтарной кислоты – щавелевая, малоновая, щавелево-уксусная – являются конкурентными ингибиторами фермента сукцинатдегидрогеназы, катализирующей окисление янтарной кислоты в фумаровую:
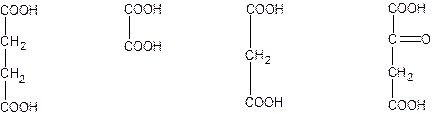
Янтарная Щавелевая Малоновая Щавелево-
кислота кислота кислота уксусная кислота
Конкурентное ингибирование может быть снято при увеличении концентрации субстрата.
Неконкурентное ингибирование отличается от конкурентного тем, что оно не может быть снято увеличением концентрации субстрата. Неконкурентный ингибитор подавляет каталитическое превращение субстрата в продукты реакции. Полагают, что при неконкурентном ингибировании ингибитор связывается с функционально важной группой фермента, не препятствуя связыванию субстрата, при этом деформируется активный центр, что приводит к нарушению комплементарности к субстрату и снижению активности фермента.
Бесконкурентное ингибирование наблюдается в том случае, когда ингибитор связывается с фермент-субстратным комплексом ES, переводя его в неактивную форму.
При смешанном ингибировании ингибитор действует как на участок связывания, так и на каталитический центр фермента.
 2015-06-26
2015-06-26 10920
10920








