ЛПЗ № 1. Ферменты генетической инженерии.
Рестриктазы были открыты при изучении явления рестрикции и модификации у бактерий, расшифрованного в основном В. Арбером (1968). Рестриктазы узнают определенные последовательности нуклеотидов и разрезают двунитевую ДНК на фрагменты. Модификация заключается в метилировании определенных оснований в последовательности, узнаваемой сопряженной рестриктазой; тем самым обеспечивается защита данного участка ДНК от воздействия рестриктазы. Одновременное наличие в клетке этих двух ферментативных активностей (так называемая R-M система) препятствует гидролизу собственной нуклеиновой кислоты. Чужеродная же ДНК при проникновении в бактериальную клетку служит субстратом для обоих ферментов.
Первоначально многие считали, что единственной функцией R-M систем является защита клеток от инфицирования фагами. Однако дальнейшие исследования позволили сделать предположение о том, что R-M системы осуществляют функцию ограничения скрещивания между различными бактериальными видами и штаммами, которая, однако, не абсолютна и позволяет части чужеродной ДНК проникать в клетку, рекомбинационно встраиваться и поддерживаться в качестве генетического фонда для получения эволюционного преимущества. Уместно заметить, что у бактерий весьма проблематично определение вида. Существуют даже предположения об общем генофонде всех микроорганизмов, что должно было бы привести к бесконечному появлению новых видов бактерий во времени. Реально же мы видим, что бактерии проявляют определенное постоянство морфологических, генетических и биохимических характеристик: Достойными кандидатами для обеспечения в эволюции относительной стабильности генетического материала, т. е. для осуществления генетической изоляции, не отрицающей обмена определенными блоками, являются системы рестрикции-модификации.
Системы рестрикции и модификации найдены практически у всех исследованных бактерий. Недавно рестриктазы обнаружены и у некоторых видов дрожжей.
В 1968 г. М. Мезельсон и Р. Юань сообщили о выделении первой рестриктазы из штамма Е. coli К12. Подобный фермент был получен и из штамма Е. coli В. Данные эндонуклеазы ЕсоК и ЕсоВ отличались высокой специфичностью по отношению к узнаваемой последовательности нуклеотидов, yо расщепляли молекулы ДНК неспецифически в другом месте, отстоящем от участка (сайта) узнавания. В 1970 г. X. Смит и К. Вилькокс выделили из Haemophius influenzae рестриктазу HindII, не только специфически узнающую, но и специфически расщепляющую молекулы ДНК. При гидролизе вирусной или плазмидной ДНК рестриктазами такого типа образуется строго определенный набор фрагментов. Это наглядно выявляется при электрофоретическом разделении смеси получающихся фрагментов.
Принципиальное значение для разработки методологии генетической инженерии имело открытие в 1971 г. Р. Ёшимори рестриктаз EcoR I и EcoR II. С помощью первой из них удалось выполнить пионерскую работу по направленной реконструкции генетического материала in vitro. В настоящее время рестриктазы используют практически во всех генно-инженерных экспериментах. Такое широкое применение ферментов данного типа обусловлено их высокой специфичностью, а также особенностями структуры концов фрагментов ДНК, образуемых рестриктазами. Общепринято термины рестриктаза, эндонуклеаза рестрикции, сайтспецифическая эндодезоксирибонуклеаза считать синонимами.
X. Смит и Д. Натане в 1973 г. предложили номенклатуру рестриктаз, которая включает следующие пункты:
1.Название каждого фермента является производным от бинарного родо-видового обозначения микроорганизма-хозяина, содержащего данную R-M систему, и составляется по следующему правилу: к первой прописной букве названия рода добавляют две первые строчные буквы вида. Например: Streploinyces albiis - Sal, Escherichia coli - Eco.
2. За родо-видовым названием следует, в случае необходимости, обозначение серотипа или штамма: Haemophihis influenzae d - Hind. Escherichia coli В - ЕсоВ.
3.Различные системы рестрикции-модификации, кодируемые одной и той же бактериальной клеткой обозначаются римскими цифрами, например: HindI, HindII, HindIII.
4. Ферменты рестрикции-модификации в общем виде обозначаются как эндонуклеаза R или метилаза М с последующим определением
названия системы, например: эндонуклеаза R * HindII или метилаза М * HindII.
5. Если система генетически локализована в геноме фага или на плазмиде, то после родо-видового названия указывается символ внехромосомного элемента: EcoРI, EcoKII. Штаммовая принадлежность в этих случаях указывается в скобках: Есо(К)РI.
Основные принципы, заложенные в этой номенклатуре, используются и в настоящее время. Однако неоднозначность в названиях, возникшая из-за лавинообразного открытия новых рестриктаз, заставила Р. Робертса в 1978 г. внести некоторые дополнения в вышеописанную систему рациональных обозначений ферментов. Смысл дополнений заключается в том, что во избежание путаницы в случае, когда название совпадает для нескольких ферментов, оставляют неизменными первые две буквы, а третью берут из последующих букв видового названия, например: Haemophihis parainfluenzae - НраI, Haemophilus parahaemolyticus - HphI. Для большей точности Д. Шибата с соавторами предложили после латинской родо-видовой символики вводить музейный номер бактериальной культуры, например: Pvu84II, Hinb 10761II.
Открытие большого числа рестриктаз и изучение их свойств позволило выявить некоторые закономерности функционирования ферментов и разделить их на три класса. Основой классификации служат в первую очередь потребность фермента в кофакторах и характер расщепления ДНК.
Различают 3 основных класса рестриктаз: 1, 2 и 3. Все рестриктазы узнают на двуспиральной ДНК строго определенные последовательности, но рестриктазы 1-го класса осуществляют разрывы в произвольных точках молекулы ДНК, а рестриктазы 2-го и 3-го классов узнают и расщепляют ДНК в строго определенных точках внутри сайтов узнавания или на фиксированном от них расстоянии.
Ферменты типов 1 и 3 имеют сложную субъединичную структуру и обладают двумя типами активностей - модифицирующей (метилирующей) и АТФ-зависимой эндонуклеазной.
Ферменты второго класса состоят из 2 отдельных белков: рестрицирующей эндонуклеазы и модифицирующей метилазы, поэтому в генной инженерии используются исключительно ферменты 2-го класса. Они нуждаются в ионах магния в качестве кофакторов.
Рестриктазы I класса, к которым относятся, к примеру, ферменты ЕсоК, EcoB, EcoPl и другие, атакуют ДНК в произвольных местах и образуют сплошной спектр рестриктов. Эти рестриктазы в генетической инженерии не используются, поскольку с их помощью нельзя получить фрагменты ДНК строго детерминированных размеров.
Рестриктазы класса II. Системы рестрикции-модификации класса II состоят из отдельных белков рестрикционной эндонуклеазы и модификационной метилазы. Поэтому рестриктазы данного класса можно выделить в индивидуальном состоянии, свободном от метилазной активности, что в значительной мере упрощает их изучение и последующее использование для расщепления молекул ДНК.
Рестриктазы класса II - относительно просто организованные белки, состоящие из двух субъединиц одного типа со сравнительно небольшой молекулярной массой. Отличительной чертой рестриктаз класса II является то, что они узнают и разрезают немодифицированную двухцепочечную молекулу ДНК по специфичным нуклеотидным последовательностям, и это приводит к образованию дискретного набора фрагментов анализируемой ДНК.
Рестриктазы класса II обычно узнают последовательности двухцепочечной ДНК длиной от 4 до 8 пн, имеющие ось симметрии второго порядка, - палиндромы. При этом ряд рестриктаз расщепляет ДНК строго по оси симметрии узнаваемой последовательности, что приводит к образованию фрагментов ДНК с тупыми концами, не имеющими выступающих одноцепочечных участков. Например, рестриктаза AluI, схема участка узнавания которой представлена на рис., осуществляет гидролиз ДНК следующим образом:
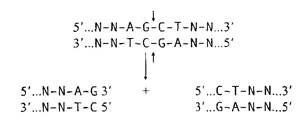
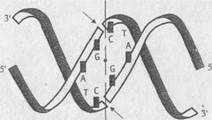
Рис. Строение участка расщепления молекулы ДНК рестриктазой AluI.
Штриховая линия - ось симметрии; стрелками обозначены места гидролиза цепей ДНК
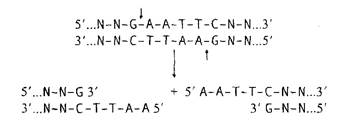 Другой фермент - EcoRI - узнает гексануклеотидную последовательность и расщепляет ее с образованием взаимокомплементарных одноцепочечных липких концов:
Другой фермент - EcoRI - узнает гексануклеотидную последовательность и расщепляет ее с образованием взаимокомплементарных одноцепочечных липких концов:
Кроме выступающих 5'-концов рестриктазы могут образовывать также липкие 3'-концы. К подобным ферментам относится рестриктаза PstI:
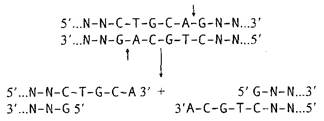
Ряд рестриктаз узнают частично вырожденные последовательности, поэтому такие ферменты не обладают столь высокой специфичностью, как рассмотренные выше.
Размер узнаваемой рестриктазой последовательности, как правило, обусловливает частоту встречаемости этих участков в природных ДНК. Для случайной последовательности ДНК бесконечной длины с равным содержанием каждого из четырех нуклеотидов вероятность наличия определенной последовательности длиной N (Рn) на молекуле ДНК будет равна 4-N, причем вырожденность последовательноcти участков узнавания, обнаруженная для некоторых рестриктаз, увеличивает данную вероятность. Средняя частота встречаемости тетрануклеотида - Р4 = 4-4 = 3,9 *10-3, октануклеотида – Р8 = 1,2*10-5. Поэтому рестриктазы, узнающие последовательность из четырех пар; нуклеотидов, часто называют мелкощепящими. а рестриктазы с участком узнавания в шесть и более пар нуклеотидов - крупнощепящими.
К мелкощепящим относятся рестриктазы Hpa II и Alu (из Arthrobacter luteus), к крупнощепящим - Eco R I (из Escherichia coli) и Hind III. Если предположить, что участки узнавания рестриктаз распределены вдоль цепи ДНК случайно, то мишень для ферментов, узнающих последовательность (сайт) из четырех нуклеотидов, должна встречаться в среднем 1 раз через каждые 256 пар оснований, а для ферментов, узнающих шесть нуклеотидов, - через 4096 пар оснований. Если сайт рестрикции окажется внутри гена, то обработка ДНК-рестриктазой приведет к его инактивации. Вероятность такого события очень велика при обработке мелкощепящими рестриктазами и незначительна при применении крупнощепящих эндонуклеаз. Поэтому с целью получения неповрежденного гена расщепление проводят поочередно несколькими крупнощепящими рестриктазами, либо применяют прием "недорестрикции", т.е. рестрикцию проводят в таких условиях, когда происходит расщепление лишь в одном сайте.
Большой интерес для экспериментов по клонированию фрагментов ДНК представляют рестриктазы, которые, обладая разной специфичностью, дают при гидролизе ДНК одинаковые липкие концы.
Целенаправленный поиск эндонуклеаз рестрикции класса II, обусловленный значением этих ферментов, привел к открытию большого числа новых рестриктаз Новой считается любая рестриктаза найденная в не изученном ранее штамме. Дальнейшие исследования позволяют решить, действительно ли данный фермент узнает новую, последовательность нуклеотидов или же является аналогом уже известной рестриктазы. В том случае, если обнаруженная рестриктаза узнает ране неизвестную последовательность, она называется прототипам. Однако часто ферменты, выделенные из различных микроорганизмов, узнают одну и ту же последовательность и при гидролизе определенной ДНК образуют одинаковый спектр фрагментов. Такие рестриктазы называют изошизомерами.В то же время, узнавая одну и ту же последовательность, рестриктазы могут по-разному расщеплять двухценочечную ДНК. Поэтому ферменты, имеющие одинаковые узнаваемые последовательности и одинаково их расщепляющие, принято называть истинными изошизомерамн. Например, рестриктазы HapII, HpaII, MnoI являются истинными изошизомерами. Рестриктазы же SmaI и ХтаI, а также RsaI и CviII имеют попарно одинаковые узнаваемые последовательности, но расщепляют ДНК различным образом. Такие ферменты принято называть ложными изошизомерами.
Рестриктазы класса III имеют некоторое сходство с рестриктазами класса I. Нативный фермент состоит из двух различных субъединиц и бифункционален, т. е. обладает как рестриктазной, так и метилазной активностью. Рестриктазы класса III узнают несимметричные последовательности длиной 5-6 пн и расщепляют ДНК в стороне от участков узнавания на расстоянии 24-27 пн, образуя одноцепочечные 5'-концы длиной 2-3 нуклеотида. Для проявления эндонуклеазной активности требуются только АТР и ионы Mg2+, a SAM лишь стимулирует ре акцию, причем расщепление ДНК не сопровождается гидролизом АТР. При действии ферментов данного класса in vitro не удается исчерпывающе гидролизовать ДНК. Причины этого пока не ясны.
Распространенность рестриктаз. Рестриктазы необычайно широко распространены в мире микроорганизмов. Показано, что рестрикция и модификация не коррелируют с патогенностью. Не обнаружено и зависимости от потребления кислорода, т. е. R-M системы имеются и в аэробах, и в анаэробах. Строение клеточной стенки также не накладывает ограничений на присутствие систем рестрикции-модификации. Необходимо подчеркнуть, что рестриктазы и метилазы не являются обязательными компонентами клетки. Штаммы, не содержащие R-M систем, иногда называют «нулевыми».
Распространенность рестриктаз в царстве прокариот поставила вопрос о возможности существования R-M систем в эукариотических клетках. Попытки обнаружить у эукариот ферменты, аналогичные рестриктазам класса II, долгое время не давали положительных результатов. В середине 1980-х гг. появились сообщения о выделении специфических эндонуклеаз из Saccharomyces cerevisiae, Pichia membranafaciens, Chlamydomonas reinhardtii. Однако данные ферменты не давали исчерпывающего гидролиза ДНК, чем напоминали рестриктазы класса III.
Всю информацию о рестриктазах и метил-трансферазах можно найти на веб-сайте www.rebase.neb.com, который регулярно обновляется.
 2015-06-26
2015-06-26 9730
9730








