Рассмотрим простейшую диаграмму состояния системы, в которой металлы не обладают полиморфизмом и неограниченно растворимы друг в друге, как в жидкой, так и в твердой фазе(рис.6.).
В этом случае на диаграмме всего три поля, разделенных двумя наклонными линиями. Два из них — поля гомогенности или поля существования насыщенных растворов — жидкого (поле I) и твердого (поле II).В поле гетерогенности (III) устойчивы две фазы. Обе линии диаграммы — ликвидуса (верхняя) и солидуса (нижняя) — не имеют точек излома, так как в системе всего одна твердая фаза (твердый раствор).
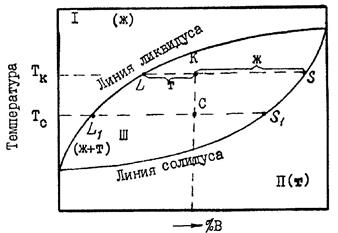
Рис. 6. Диаграмма состояния системы, компоненты которой неограниченно растворимы как в жидкой, так и в твердой фазе
Любая точка внутри поля гетерогенности, например, точка “k”, указывает температуру и состав смеси двух фаз. При заданной температуре (Тк) система безвариантная (С=0). Это означает, что независимо от соотношения в количествах равновесных фаз их составы определяются однозначно, им отвечают точки на линиях насыщения: точка "L" на линии ликвидуса указывает состав расплава, а точка "S" на линии солидуса — состав твердой фазы.
Согласно правилу отрезков (рычага), точка "к", отвечающая составу смеси двух фаз, делит отрезок LS на части, обратно пропорциональные их количествам.
Если составы на диаграмме состояния выражены массовыми процентами, то отрезок LК пропорционален массе твердой фазы (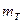 ), а отрезок КS — массе жидкости (
), а отрезок КS — массе жидкости (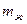 ), и правило отрезков примет вид:
), и правило отрезков примет вид:
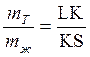 или
или 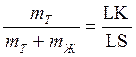 (2).
(2).
Если же составы выражены мольными процентами, то отрезки LK и KS будут пропорциональны числу молей твердой (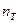 ) и жидкой (
) и жидкой (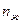 )
)
фаз соответственно, и правило отрезков запишется в виде:
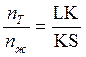 или
или 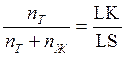 (3).
(3).
В двухфазной системе изменение температуры вызывает изменение составов фаз и, следовательно, соотношений в их количествах. Например, у системы, заданной точкой “k” (см. рис. 6), понизим температуру от Тk до Тс. При этом состав жидкости изменится от “L” до " L1", а состав твердой фазы от “S” до “S1“а также изменится длина отрезков, пропорциональных количествам жидкой и твердой фаз. В рассмотренном примере увеличивается доля кристаллов и уменьшается доля жидкости.
Правило отрезков применимо к гетерогенным системам и, следовательно, в пределах любого поля гетерогенности.
ЛИНИИ БЕЗВАРИАНТНЫХ РАВНОВЕСИЙ И ИЗОТЕРМИЧЕСКИЕ ПРЕВРАЩЕНИЯ С УЧАСТИЕМ ТРЕХ ФАЗ
Любая горизонтальная линия диаграммы отвечает безвариантному равновесию трех конденсированных фаз. При внешнем воздействии на подобную систему (подводе или отводе тепла) равновесие смещается и возникает самопроизвольно протекающий процесс, при котором ни температура, ни составы фаз изменяться не могут (С=0). Такие изотермические превращения с участием трех конденсированных фаз протекают по двум схемам:
а) распад одной фазы на две другие;
б) взаимодействие двух фаз с образованием третьей.
В качестве примера рассмотрим превращения с участием одной жидкой и двух твердых фаз, происходящие при отводе тепла от системы.
1. Эвтектическое превращение, сводящееся к одновременной кристаллизации двух твердых фаз из жидкости (схема "а"). Его можно описать следующим уравнением:
ЖЕ=Тa+Тв; ∆H<0 (4)
где ЖЕ - жидкость(расплава) эвтектического состава "Е";
Та, Тв - твердые фазы состава точек "а" и "в" соответственно.
Эвтектическому превращению на диаграмме состояния удовлетворяет горизонталь (рис. 7,а), граничные точки которой ("а" и "в") указывают составы твердых фаз, а между ними располагается точка “Е” (состав жидкости).
В точке "Е" должны сходиться две ветви ликвидуса, так как жидкость такого состава насыщена двумя твердыми фазами, а ветви солидуса должны подходить к точкам "а" и "в". На диаграмме (см. рис. 2) две линии эвтектического происхождения. Одна из них линия ДЕF. На ней к точке "Е", указывающей состав жидкой эвтектики, подходят ветви ликвидуса  Е и
Е и  Е. Точки "Д" и "F" указывают составы твердых фаз, к ним подходят линии солидуса
Е. Точки "Д" и "F" указывают составы твердых фаз, к ним подходят линии солидуса  Д и
Д и  F. Другая линия эвтектического превращения Д'Е'F1. На ней точка "Е" отвечает составу жидкой эвтектики и точки "Д" и "F" — составам твердых фаз.
F. Другая линия эвтектического превращения Д'Е'F1. На ней точка "Е" отвечает составу жидкой эвтектики и точки "Д" и "F" — составам твердых фаз.
2. Перитектическое превращение, при котором жидкость перитектического состава (точка “Р”) взаимодействует с ранее выпавшей твердой фазой (например, состава точки "а") и дает новую твердую фазу (состава точки “в”). Такому превращению, протекающему по схеме "б", удовлетворяет уравнение
Жр+Та=Тв;h∆H<0 (5).
На линии перитектического превращения (рис. 7,б) граничные точки "р" и “а” (составы взаимодействующих фаз) и между ними точка "в" (состав вновь возникающей фазы).

Рис. 7. Расположение составов равновесных фаз на линии эвтектического (а) и перитектического (б) превращения
Такое размещение составов равновесных фаз на линиях эвтектического и перитектического превращений согласуется с правилом отрезков, по которому состав смеси двух фаз всегда располагается между составами смешиваемых фаз.
На диаграмме, приведенной ранее (см. рис. 5), линия перитектического превращения ВСР. На ней к точке "р" подходит линия ликвидуса ар, точки "в" и "с" совпадают с составами твердых фаз А и АmВn соответственно.
Таким образом, линии эвтектического и перитектического превращений отличаются местоположением состава жидкой фазы. Состав жидкой эвтектики располагается между составами твердых
фаз, а состав жидкой перитектики находится по одну сторону от составов твердых фаз.
Возможные превращения с участием трех конденсированных фаз и уравнения, их описывающие, приведены в табл. 2.
Таблица 2
Возможные изотермические превращения с участием трех конденсированных фаз
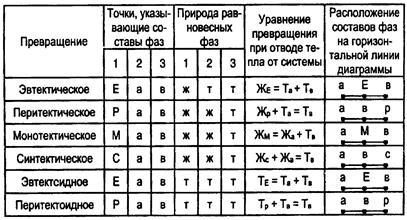
Из табл. 2 видно, что монотектическое и эвтектоидное превращения протекают по такой же схеме, как и эвтектическое (схема “а”),только в первом участвуют две. жидких фазы и одна твердая, а во втором — все три фазы твердые. Аналогом перитектического превращения являются синтетическое и перитектоидное, им
удовлетворяет схема "б".
 2015-07-04
2015-07-04 785
785








