Зрілі Т-лімфоцити, які покидають тимус, приймають фенотип так званих клітин у стані спокою і називаються «незайманими» лімфоцитами (naїve lymphocytes- спорідненість з українською мовою- Ї). Цей контакт пов’язаний з розпізнаванням ряду сигналів, про що ми говорили перед цим, але нагадаю:
1- від TCR рецептора, що розпізнав антиген, представлений антигенпрезентуючою клітиною (АПК). ДИВ ПОПЕРЕДНЮ ЛЕКЦІЮ - БУДОВА І ФУНКЦІЇ TCR ТА ВCR ТА МОЛЕКУЛ МНС.
2- від корецепторів -молекул CD 4 (CD 4 + = Т-лімфоцити-хелпери= розпізнавання антигену в контексті з молекулами МНС II класу= презентація екзогенних антигенів) та CD 8 (CD 8+ = Т-лімфоцити-кілери=цитотоксичні Т-лімфоцити -ЦТЛ=супресорні Т-лімфоцити= розпізнавання антигену в контексті з молекулами МНС I+ класу). Головні функції корецепторів: а) зв’язування з найближчими до мембран АПК надклітинними ділянками МНС; б) їх цитоплазматичний домен зв’язується з тирозиновими протеїнкіназами родини Src (Lck), притягуючи їх до Т-клітинного рецептора.
3- від костимуляторних молекул;
4- цитокінів, які стимулюють "експресію" костимуляторних молекул. ДИВ КІНЕЦЬ ЛЕКЦІЇ
Місцем активації Т-лімфоцитів є периферичні лімфатичні органи (наприклад, лімфатичні вузли), куди лімфоцити проникають через судини з високим ендотелієм. Там знаходяться АПК, але першим контактом Т-лімфоцитів з останніми є взаємодія між собою їх молекул адгезії (ІCAM-1/2 на АПК - LFA-1 на Т-лімфоцитах та LFA-3 на АПК - CD 2 на Т-лімфоцитах.). Сила зв’язку цих молекул є порівняно малою, проте достатньою для того, щоб TCR міг розпізнати специфічні антигенні детермінанти в контексті МНС антигенпрезентуючих клітин. Якщо розпізнавання специфічного антигену не відбулося (рис.1, А), лімфоцит відлучається від АПК, зберігаючи фенотип непроліферуючого лімфоцита.
Насьогодні постулюється, що сигналінг ініціюється кластеризацією рецепторів за рахунок перехресного зв’язування полівалентних антигенів.
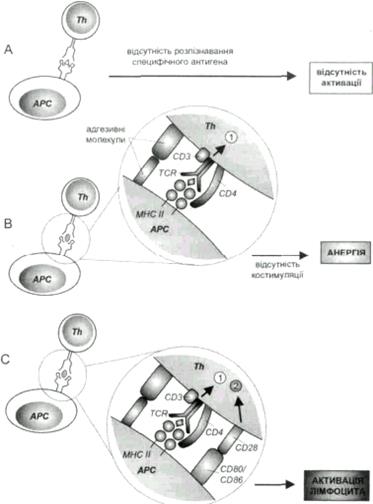
Рис. 1. Нормальна активація Т-лімфоцита СD4+ вимагає отримання від антигенпрезентуючої клітини (АРС) щонайменше двох незалежних сигналів, переданих через ТСR (перший сигнал) та костимулюючі молекули (другий сигнал). А. Відсутність передачі сигналу через ТСR не призводить до тривалих змін у лімфоциті. В. Розпізнавання антигену без нормальної костимуляції призводить до стану анергії. С. Розпізнавання антигену з одночасною костимуляцією через шлях СD28-СD80/СD86 призводить до активації Т- лімфоцита. Аналогічні явища відбуваються при активації лімфоцитів СD8+ за участю молекули МНС І класу та молекули СD8
Процеси проліферації і диференціації, так і апоптозу, що реалізуються у клітині за участі каскадних біохімічних реакцій, ведуть до активації певних транскрипційних факторів, черговість стимуляції і співвідношення яких визначають подальшу долю клітини.
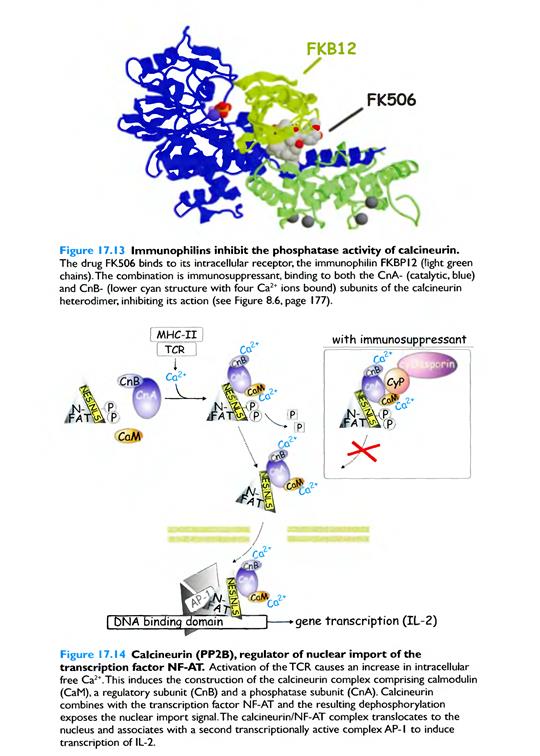
Для активації лімфоцитів необхідно, щоб у результаті стимуляції рецепторів активувалися принаймні три головних транскрипційних фактори — NF-AT (від англ. nuclear factor of activated T-cells - ядерний фактор активованих Т-клітин), NF-кВ (від англ. nuclear factor for K-chain expression in B-cells — ядерний фактор, необхідний для експресії k-ланцюга імуноґлобулінів у В-клітипах) та АР-1.
NF-AT активується в кінці фосфатидил-інозитидного шляху з залученням специфічних фосфатаз: ліганд/рецептор → кінази родини Src→ кінази родини Syk/Zap-70→адапторні білки→ фосфоліпаза Сγ→ІФ3→Са 2+↑→ кальмодулін активує серин-треонін фосфатазу кальциневрин →дефосфорилювання транскрипційного фактору NF-AT, який після транслокації до ядра активує певні гени, що приводить кінець кінцем до клітинної проліферації та диференціації.
NF-кВ — активується в кінці фосфатидил-інозитидного шляху з залученням специфічних протеїнкіназ: ліганд/рецептор→ кінази родини Src→ кінази родини Syk/Zap-70→адапторні білки→ фосфоліпаза Сγ→ДАГ→ протеїнкіназа PK C θ →NF-кВ →транслокація до ядра з активацією певних генів, що приводить кінець кінцем до клітинної проліферації та диференціації.
Транскрипційний фактор NF-кВ також фосфорилюється протеїнкіназою PKB/AKT, активується і стимулює ген білка А1/ Bfl1, що належить до родини Bcl-2 білків- антиапопоптичних, які входять до складу мітохондріальних мембран і закривають (блокують) канали мх мембран. Також завдяки NF-кВ відбувається стимуляція синтезу інгібіторів каспаз ІАР s. Таким чином цей фактор активує мітотичні каскади. У разі залучення до апоптозу TNFά —> церамід —>
ПК А—> NF-кВ —>стимуляція NO синтази—>накопичення NO = загибель клітини. Протеїнфосфатаза PTEN має протилежну дію до PKB/AKT, активуючи проапоптичні процеси.
Фактор АР-1 утворюється внаслідок поєднання факторів Fos і Jun, які активуються в кінці різних каскадів МАР-кіназ, які в свою чергу активуються завдяки фосфатидил-інозитидного шляху передачі сигналу: ліганд/рецептор → кінази родини Src→ кінази родини Syk/Zap-70→адапторні білки→ фосфоліпаза Сγ→ДАГ →G білок Ras→ МАР кіназний каскад →Jun і Fos → АР1 →транслокація до ядра з активацією певних генів, що приводить кінець кінцем до клітинної проліферації та диференціації.
Розглядаючи попередні етапи, ми фактично описали функційні події активації лімфоцитів до моменту залучення Zар-70. Активовані кінази
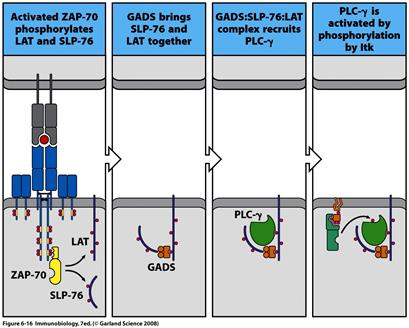
Zар-70 фосфорилюють значну кількість білків, що входять до складу сигнального комплексу, наприклад скафолдні білки LAT та SLP-76, які взаємодіють з адапторним білком GADS (рис. 6.16). LAT є трансмембранним міристильованим білком, який входить до складу LIPID RAFTS і взаємодіє з Zар-70.
Залучення до складу сигнального комплексу скафолдних білків LAT та SLP-76 у Т-лімфоцитів та ВLNK/SLP-65 у В-лімфоцитів є важливим ключовим моментом передачі сигналу, оскільки до цих білків приєднується ціла низка ферментів, кожний з яких зумовлює свій власний шлях сигналінгу. Це, насамперед, фосфоліпаза Сγ, яка ініціює фосфатидилінозитольний шлях передачі сигналу, фосфатидилінозитол-3-кіназа, що зумовлює приєднання до мембрани білків, які містять РН-домени, та малі G -6ілки, які активують шлях МАР-кіназ. Розглянемо кожний із цих шляхів подальшої передачі сигналу детальніше.
Активація фосфоліпази Сγ та фосфатидилінозитольний шлях передачі сигналу (рис.6.16, 6.17)
РLСγ приєднується до адапторних білків після їх фосфорилювання кіназами Syk/Zар-70-родини (скафолдні білки LAT та SLP-76 в комплексі з адапторним білком GADS). Субстратом РLСγ є фосфоліпіди, які входять до складу плазматичної мембрани клітин. Наближення каталітичного домену фосфоліпази до мембрани є необхідною умовою для потрапляння ФІФ2 до активного центру РLСγ. Таке наближення стає можливим після зв'язування SН2- та SНЗ-доменів фосфоліпази з адапторними і скафолдними білками, а РН-домену — з ФІФЗ мембрани.
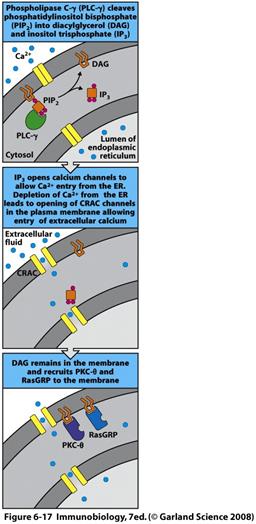 Після зв'язування РLСγ з примембранним сигнальним комплексом відбувається її активація. В цьому процесі беруть участь тирозинові кінази сигнального комплексу. Вважають, що в активації РLСγ можуть брати участь тирозинові кінази трьох родин — Src, Syk/Zар-70 і Тес. Саме останні вважаються насьогодні основними індукторами активації фосфоліпази Сγ.
Після зв'язування РLСγ з примембранним сигнальним комплексом відбувається її активація. В цьому процесі беруть участь тирозинові кінази сигнального комплексу. Вважають, що в активації РLСγ можуть брати участь тирозинові кінази трьох родин — Src, Syk/Zар-70 і Тес. Саме останні вважаються насьогодні основними індукторами активації фосфоліпази Сγ.
Активація фосфоліпази Сγ є ключовим моментом передачі сигналу від антиген-специфічних рецепторів Т- і В-клітин, оскільки вона продукує найважливіші вторинні месенджери ДАГ та ІФЗ, які необхідні для активації клітини.
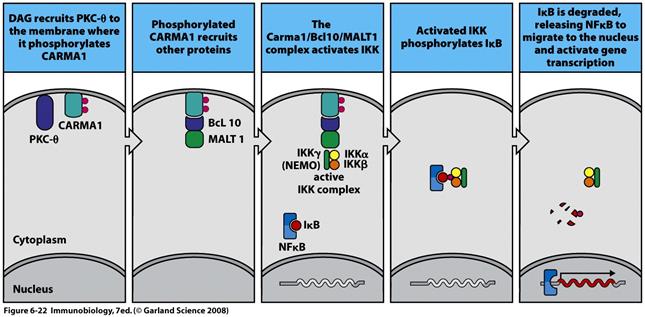
ДАГ залишається зв'язаним з мембраною, а ІФЗ потрапляє в цитозоль. ДАГ активує мембранозв'язану форму протеїнкінази С (РКСθ-тета), яка може фосфорилювати низку білків за залишками серину й треоніну. Субстратами протеїнкінази С є деякі транскрипційні фактори (NF-κB), рецептори та примембранні білки, а також кіназа Rаs. Активуючи кіназу Rаs, протеїнкіназа С здатна запускати інший шлях передачі сигналу — шлях МАР-кіназ.
Транскрипційний фактор NF-κB
Один з найважливіших сигналів по низхідній (downstream) від PK C γ приводить до активації ізоформи PK C - PK C θ (за дії ДАГ і Са2+). Транскрипційний фактор NF-κB активується за дії протеїнкінази С (PK C θ). Це в свою чергу приводить до вивільнення фактору NF-κB від інгібітору в цитоплазмі з подальшим проникненням активного фактору до ядра.
NF- κB - загальна назва для членів родини гомо – і гетеродимерних транскрипційних факторів (білки родини Rel). У лімфоцитах це найчастіше гетеродимер р50/ р65 Rel. Димер існує в неактивному стані в цитоплазмі за умови зв’язування з інгібіторним білком IκB. Під час сигналінгу через антигенний рецептор мембранний ДАГ рекрутує і активує PK C θ, яка фосфорилює скафолдний білкок CARMA1, який в свою чергу зв’язує білки Bcl10 і MALT1 з утворенням мембранно-асоційованого комплексу. Цей комплекс рекрутує і активує серин/треонінові протеїнкінази (IКК)=IκB кінази, які функціонують у вигляді трьохсубодиничного комплексу (IККα IККβ IККγ=NEMO). Фосфорилювання IκB стимулює його убіквітинування та подальшу деградацію з залученням протеасоми. Отже і відповідно вивільнений NF- κB транслокується до ядра. де він стимулює транскрипцію ряду генів. Певні дефекти NEMO, які попереджають активацію NF- κB, призводять до виникнення імунодефіцитів.
Транскрипційний фактор NF-АТ
ІФЗ зв'язується з рецепторами на мембрані ендоплазматичного ретикулуму, внаслідок чого кальцієві канали відкриваються і йони Са2+ надходять у цитозоль. Слід зазначити, що кожний канал відкривається тільки на мілісекунди, після чого переходить у неактивний стан. Саме тому для істотного збільшення в цитоплазмі концентрації йонів Са2+ потрібна значна кількість молекул ІФЗ. Для відновлення рівня кальцію клітина активує кальцієві канали цитоплазматичної мембрани, які отримали назву CRAC CHANNELS. Йони Са2+ зв'язуються з кальмодуліном, який активує кальмодулінзалежну серин-треонінову фосфатазу кальцинейрин, у результаті чого остання активується і дефосфорилює транскрипційний фактор NF-АТ. Після дефосфорилювання NF-АТ мігрує в ядро, де ініціює транскрипцію певних генів.
Крім того, йони Са2+ зв'язуються з цитоплазматичною формою РКС, унаслідок чого РКС сполучається з мембранним ДАГ. Отже, в активації РКС беруть участь обидва вторинні месенджери, продуковані фосфоліпазою Сγ: ДАГ — безпосередньо, а ІФЗ — опосередковано, через йони Са2+ .
Роль РР2В(протеїн-тирозинфосфатаз- РТР), а саме кальцинейрина= calcineurine в регуляції Т-клітинної проліферації
Хоча насьогодні відомо, що РР2В широко розповсюджені у ряді тканин, вперше було знайдено як кальцій- зв’язуючий білок у нейрональних тканинах і згідно з цим фермент отримав назву кальцинейрина. Пізніше було встановлено, що він має фосфатазну активність і його регуляторна субодиниця- Са 2+- зв’язуючий білок кальмодулін. Весь комплекс складається з трьох субодиниць: кальценейрина А (каталітичної субодиниці), кальценейрина В(регуляторної кальмодулін-подібної субодиниці) і самого кальмодуліна. Кальцинейрин може бути активованим шляхом підвищення концентрації цитозольного Са 2+, чи шляхом фосфорилювання кальциней-
рина В, що має ефект підвищення Са 2+- спорідненості, таким чином, гарантуючи, що активація може відбуватись навіть за концентрації Са 2+, яка відповідає спокою (resting concentration).
Кальцинейрин бере участь у трансдукції сигналу від TCR через шлях,
до якого залучена PLCγ, а саме: утворення DAG, IP3 та підвищення
концентрації Са 2+ приводить до активації фосфатази кальцинейрину, який,
в свою чергу, активує транскрипційний фактор NF-AT ( n uclear f actor of
a ctivated T cells). Це є необхідним для клональної експансії Т клітин,
оскільки відіграє центральну роль в індукції експресії IL-2. NF-AT вимагає
допомоги АР-1 (activator protein-1 complex=Jun+Fos, які активуються через
шлях Ras/ERK). Цей процес є трьох стадійним:
дефосфорилювання, транслокація до ядра, підвищення спорідненості до ДНК
(див рис.).
 |
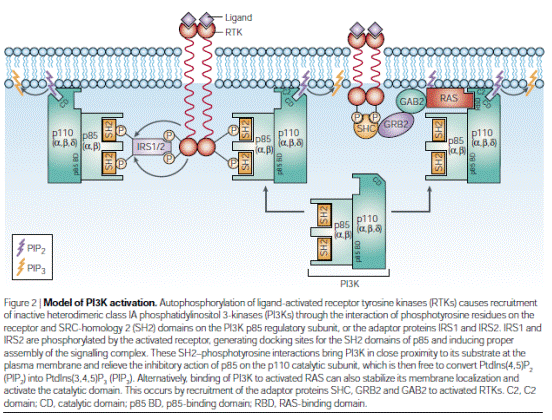
Активація фосфатидилінозитол-3-кінази. Фосфатидилінозитол-3-кіназа (РІЗ-кіназа) складається з двох субодиниць — регуляторної р85 та каталітичної р110. Регуляторна субодиниця містить кілька доменів, які беруть участь у білок-білкових взаємодіях: SHЗ-домен, два SН2-домени та дві ділянки, багаті на залишки проліну -ТН домени. Ці домени зв'язуються з багатьма внутрішньоклітинними білками, внаслідок чого регулюється локалізація та функціональна активність РІЗ-кінази. Так, пролінзбагачені послідовності зв'язуються з SНЗ-доменами тирозинових кіназ Src-родини: Lyn та Fyn, SН2-домени регуляторної р85 зв'язуються з фосфорильованими тирозинами адапторних білків і відіграють важливу роль в активації кінази. Зв'язування РІЗ-кінази з примембранними білками потрібне для розміщення каталітичної субодиниці р110 біля мембрани, що забезпечує потрапляння субстрату до активного центру кінази. Активацію РІЗ-кінази підсилюють також G-білки, зокрема ГТФаза Rаs, яка взаємодіє безпосередньо з каталітичною субодиницею РІЗ-кінази.
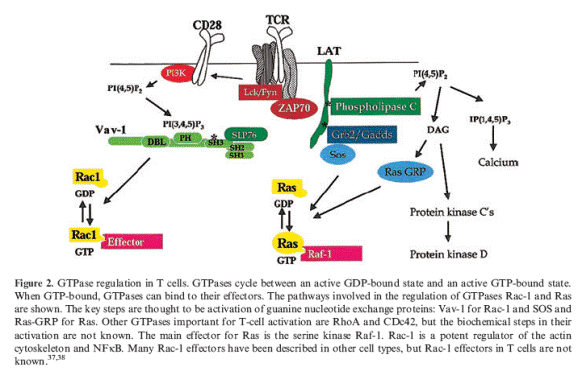 |
Активована РІЗ - кіназа фосфорилює інозитольне кільце похідних фосфатидилінозитолу в положенні 3, перетворюючи, наприклад, фосфатидил-інозитол-4,5-дифосфат (ФІФ2) на фосфатидилінозитол-3,4,5-трифосфат =ФІФЗ. ФІФЗ залишається в складі мембрани, де він виконує функцію сайту зв'язування ряду сигнальних білків, що містять РН-домени. Нагадаємо, що РН-домени входять до складу тирозинових кіназ Тес-родини (Btk, Itk та ін.), фосфоліпази Сγ, а також фактора Vаv, що активує ГТФази родини Rho .Отже, при активації РІЗ-кінази і накопиченні ФІФЗ у мембрані всі ці білки приєднуються до мембрани, що є необхідною умовою для подальшого проходження сиґналу. У клітинах, що не містять РІЗ-кіназу, спостерігається дуже слабка активність фосфоліпази Сγ у відповідь на стимуляцію рецепторів. Це пов'язано з тим, що для активації фосфоліпази Сγ потрібні кінази Тес-родини, а для активації кіназ Тес-родини та їх наближення до фосфоліпази Сγ потрібний ФІФЗ, який продукується РІЗ-кіназою. Тому РІЗ-кіназа підсилює сигнал, що передається фосфоліпазою Сγ. Проте, з іншого боку, РІЗ-кіназа та фосфоліпаза Сγ «працюють» з одним субстратом — ФІФ2 і здатні конкурувати за нього. Така конкуренція за субстрат є важливою для регулювання інтенсивності й тривалості передачі сигналу, а також може зумовлювати зміни концентрації йонів Са2+ в цитоплазмі при відповіді на подразнення рецептора. Отже, основною функцією РІЗ-кінази є модуляція активності фосфоліпази Сγ, яка є ключовим ферментом передачі сигналу від антигенспецифічних рецепторів Т- і В-клітин.
 |
Активація каскаду МАР-кіназ. Приєднання адапторних білків до сигнального комплексу та їх фосфорилювання тирозиновими кіназами призводить також до активації малих G -білків Ras і Rho. Зв'язані з ГТФ форми Ras- і Rho-ГТФаз активують каскад МАР-кіназ (від англ. m itogen- а сtіvated р rotein kіпаsе — активовані мітогенами кінази). На кінцевому етапі трансдукції сигналу МАР-Кіназа Еrk (від англ. Ехtracellular activated kinase - кіназа, що активується позаклітинними сигналами) спричиняє активацію фактора транскрипції Еlk, який, у свою чергу, ініціює транскрипцію гена Fоs. МАР-Кіназа Jnk (від англ. Jun-N-terminal kinase — кіназа N-кінця фактора Jun) зумовлює активацію протоонкогена Jun.
Продукти протоонкогенів Jun і Fos об'єднуються, внаслідок чого утворюється фактор транскрипції АР-1, що є головним наслідком передавання сиґналу по каскаду МАР-кіназ та ініціює транскрипцію генів, необхідних для поділу клітини.
 2015-07-04
2015-07-04 1585
1585








