Известно, что переход вещества из одного агрегатного состояния в другое сопровождается резким, скачкообразным изменением его физических свойств Так, лёд, вода и пар даже по внешним признакам совершенно не похожи друг на друга
Мы уже отмечали, что фазовые превращения обычно происходят при сохраняющихся значениях температуры и давления, так как именно они отражают внутреннее состояние вещества. В связи с этим при исследовании фазовых превращений целесообразно проследить за поведением удельной свободной энтальпии g(T, p) вещества (в общем случае конкретной фазы рассматриваемого компонента), которая совпадает с его химическим потенциалом m(Т,р).
Являясь характеристической функцией, удельная энтальпия не может изменяться скачком, причём даже в зоне фазовых переходов. Обнаружено, что в природе встречаются два типа фазовых переходов. Так, существует обширная группа переходов, которые сопровождаются скачкообразным изменением (разрывом) первых частных производных удельной свободной энтальпии. Их стали обобщённо называть фазовыми переходами первого рода. Кроме них встречаются гораздо менее ярко выраженные фазовые переходы, в которых первые частные производные энтальпии изменяются непрерывно, а разрыв обнаруживают вторые частные производные от удельной свободной энтальпии. В связи с этим они получили обобщённое название фазовых переходов второго рода.
Фазовые переходы, связанные с агрегатными превращениями, являются фазовыми переходами первого рода.
Уравнение Клапейрона-Клаузиуса для таких переходов можно записать в виде
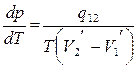 , (7.9.1)
, (7.9.1)
где 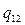 - удельная теплота фазового перехода, а
- удельная теплота фазового перехода, а 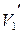 и
и 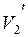 - удельные объемы фаз.
- удельные объемы фаз.
Если известна скрытая удельная теплота фазового перехода и удельные объемы вещества в соответствующих фазах как функции температуры, то при помощи уравнения Клапейрона - Клаузиуса можно определить зависимость давления, при котором фазы находятся в равновесии, от температуры.
Из уравнения Клапейрона - Клаузиуса следует, что знак производной dр/dT, т.е. наклон зависимости р(Т) определяется тем, возрастает или уменьшается удельный объем вещества при поглощении теплоты.
Поскольку при испарении жидкости или твердого тела (сублимации) объем всегда возрастает, то dр/dT для кривой испарения и сублимации положительнаи, следовательно, кривые испарения и сублимации в координатах (р,Т) имеют вид восходящих ветвей (рис. 7.9.1 а). При плавлении вещества его удельный объем, как правило, тоже возрастает (хотя имеются и исключения - например, вода, объем жидкой фазы которой меньше, чем объем твердой фазы - льда) (рис.7.9.1. б). Поэтому обычно dр/dT>0 и кривая плавления такжеимеетвид восходящей кривой. Однако, например, у воды dр/dT < 0, и увеличение давления ведет к понижению температуры плавления (если сжимать лед, то можно его растопить, не повышая температуру).
Рассмотрим график зависимости давления, при котором имеется равновесие двух фаз (газа и жидкости), от температуры (рис.7.9.2). Этот график называется фазовой диаграммой. Т.к. dP/dT>0 всегда, то эта зависимость имеет вид восходящей кривой. Эта кривая ограничена сверху критической температурой Ткр. Если р > р(Ткр), то увеличение температуры жидкости ведет к испарению без прохождения двухфазного состояния. Переход из жидкого состояния в газообразное происходит при Т = Ткр, когда нет различия между жидким и газообразным состоянием, и при переходе всегда присутствует только одна фаза (путь L2 из точки 1 в точку 2). Если же р < р(Ткр), то переход из точки 1 в точку 2 идет через двухфазное состояние (путь L1) (рис. 7.9.2).
В области низких температур кривая равновесия жидкость-газ ограничена снизу так называемой тройной точкой (Tтр). Это температура Tтр, при которой начинается кристаллизация вещества для данного давления. Температура Tтр и соответствующее ей равновесное давление Р(Tтр) - единственные значения температуры и давления, при которых могут находиться в равновесии три фазы вещества: твердая, жидкая и газообразная. Если же на фазовой диаграмме изобразить температурные зависимости для равновесного давления перехода плавления и перехода сублимации, получим диаграммы, изображенные на рис. 7.9.1.
Кривые плавления, испарения и сублимации разбивают координатную плоскость на три области. Слева от кривых сублимации и плавления лежит область твердой фазы. Между кривыми плавления и испарения заключена область жидкого состояния. Справа от кривых сублимации и испарения лежит область газообразного состояния. Любая точка в одной из этих областей изображает однофазное состояние вещества, а на одной из кривых - двухфазное состояние. Тройная точка соответствует равновесию трех фаз. Вся же диаграмма называется диаграммой состояния.
 2015-07-04
2015-07-04 1077
1077