Пример 6. Прочесть диаграмму состояния системы (рис. 60).

Рис. 60. Трехкомпонентная диаграмма состояния
Решение. 1. Общая характеристика диаграммы: диаграмма состояния трехкомпонентной конденсированной системы с одним двойным химическим соединением, плавящимся без разложения; полиморфные превращения отсутствуют. Компоненты системы неограниченно растворимы друг в друге в жидком состоянии и полностью не растворимы в твердой фазе.
2. Нумерация полей диаграммы и значимые точки диаграммы показаны на рис. 61.
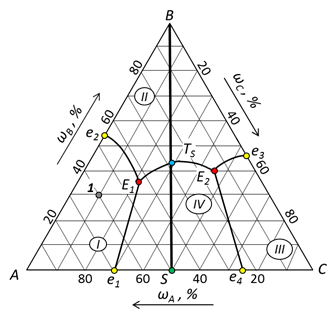
Рис. 61. Диаграмма состояния с обозначенными полями и значимыми точками.
3. Вывод формулы химического соединения. Химическое соединение содержит 50 % компонента А и 50 % компонента С. Принять массу химического соединения равной 100 г – 100 %. Тогда масса компонента А равна 50 г, компонента С – 50 г. Найти количество вещества каждого из компонентов:
Соотнести полученное число моль как простые целые числа:
4. Расшифровка фазового состава полей диаграммы. В поле I происходит кристаллизация компонента А, следовательно здесь в равновесии находятся кристаллы А и жидкая фаза. В поле II происходит кристаллизация компонента В, следовательно в равновесии будут кристаллы В и жидкая фаза. В поле III кристаллизуется компонент С; в равновесии будут кристаллы С и жидкая фаза. В поле IV кристаллизуется вещество S; в равновесии кристаллы S и жидкая фаза.
5. Процессы на граничных линиях. На линии двойной эвтектики е 1 Е 1 происходит кристаллизация А и S; уравнение равновесия: 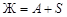 . На линии двойной эвтектики е 2 Е 1 происходит кристаллизация компонентов А и В; уравнение равновесия:
. На линии двойной эвтектики е 2 Е 1 происходит кристаллизация компонентов А и В; уравнение равновесия: 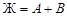 . На линии двойной эвтектики Е 1 Е 2 протекает кристаллизация В и S; уравнение равновесия:
. На линии двойной эвтектики Е 1 Е 2 протекает кристаллизация В и S; уравнение равновесия: 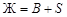 . На линии двойной эвтектики е 3 Е 2 идет кристаллизация В и С; уравнение равновесия:
. На линии двойной эвтектики е 3 Е 2 идет кристаллизация В и С; уравнение равновесия: 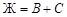 . На линии двойной эвтектики е 4 Е 2 идет кристаллизация С и S; уравнение равновесия:
. На линии двойной эвтектики е 4 Е 2 идет кристаллизация С и S; уравнение равновесия: 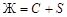 .
.
Точками двойных эвтектик являются е 1, е 2, е 3, е 4 и ТS. Уравнения равновесий в этих точках совпадают с равновесиями соответствующих линий двойных эвтектик. Например, равновесие в точке в точке е 1 совпадает с линией е 1 Е 1: 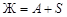 ; точке е 2 соответствует линия е 2 Е 1:
; точке е 2 соответствует линия е 2 Е 1: 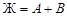 , точке е 3 – линия е 3 Е 2:
, точке е 3 – линия е 3 Е 2: 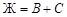 , точке е 4 – линия е 4 Е 2:
, точке е 4 – линия е 4 Е 2: 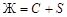 ; равновесие в точке ТS совпадает с равновесием линии Е 1 Е 2:
; равновесие в точке ТS совпадает с равновесием линии Е 1 Е 2: 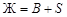 .
.
Точками тройных эвтектик являются Е 1 и Е 2. Равновесие в точке Е 1: 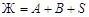 ; равновесие в точке Е 2:
; равновесие в точке Е 2: 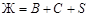 .
.
6. Построение разверток диаграммы показано на рис. 62.

Рис. 62. Развертки к сторонам диаграммы рис. 60: по стороне АС (а) по стороне АВ (б) и по стороне ВС (в).
7. Направления падения температуры по сторонам и граничным линиям показаны на рис. 63.
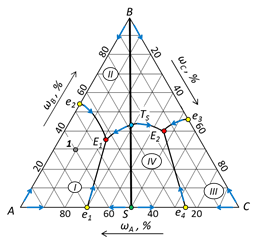
Рис. 63. Направления падения температуры.
8. Пути кристаллизации для фигуративных точек 1 – 5 показаны стрелками на рис. 64.
Рис. 64. Пути кристаллизации фигуративной точки, пояснения к заполнению таблицы и кривая охлаждения.
9. Расчет систем, заданных фигуративными точками.
Характеристика отдельных фигуративных точек диаграммы
| Точка | Общий состав системы, % | Кол-во фаз в точке | Наименование фаз | Состав каждой фазы, % | Относительное кол-во фаз, % | Число степеней свободы | ||||
| А | В | С | А | В | С | |||||
| Ж | 70,2 | |||||||||
| А | 29,8 | |||||||||
| 1' | Ж | 46,7 | ||||||||
| А | 30,4 | |||||||||
| В | 22,9 | |||||||||
| Е 1 | Ж | 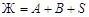
| ||||||||
| А | ||||||||||
| В | ||||||||||
| АС |
Расчет точки 1. Общий состав системы определяется по шкалам составов на сторонах треугольника. Точка 1 принадлежит полю I, следовательно в ней в равновесии находятся кристаллы А и жидкая фаза состава 1'. Относительное содержание каждой фазы определяется по правилу рычага:
доля жидкой фазы определяется длиной отрезка [ A -1]:
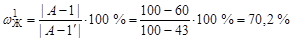 ;
;
доля кристаллов А определяется длиной отрезка [1-1']:
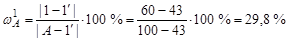 .
.
Если принять массу системы за 100 г, то масса жидкости составит 70,2 г, а масса кристаллов А 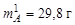 .
.
Расчет точки 1'. Общий состав системы определяется по шкалам составов на сторонах треугольника. Точка 1' находится на линии двойной эвтектики е 2 Е 1. В равновесии находятся кристаллы компонентов А, В и жидкая фаза состава Е 1. Относительное содержание каждой фазы определяется по правилу рычага. Для этого следует провести ноду от точки Е 1 через точку 1 до пересечения с линией состава бинарной системы АВ, т.е. со стороной треугольника (точка 1'').
Доля жидкой фазы определяется длиной отрезка [1-1'']:
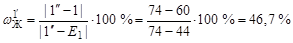 ;
;
доля твердой фазы определяется длиной отрезка [1- Е 1]:
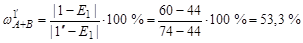 .
.
Относительное количество кристаллов А и В определяется правилом рычага с использованием стороны треугольника АВ:
Массовая доля кристаллов А определяется отрезком [ B -1'']:
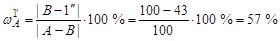 ;
;
Массовая доля кристаллов В определяется отрезком [1''- A ]:
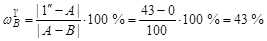 .
.
Масса системы была принята за 100 г. Тогда после охлаждения точки 1' до температуры Е 1 масса жидкости составит 46,7 г, а масса твердой фазы 53,3 г. Массы компонентов А и В численно равны их массовой доле в системе: 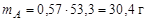 ,
, 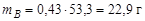 .
.
Расчет точки Е1. В точке Е 1 система распадается на 4 фазы по уравнению равновесия: 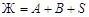 интерес представляет состав твердой фазы, как результата окончательной кристаллизации системы, т.е. состояние системы при температуре чуть ниже, чем точка Е 1. В твердую фазу полностью входят компоненты С (в составе химического соединения) и В. Для точки 1 компонент А находится в избытке по отношению к С и его масса распределяется между составом химического соединения и чистым веществом. Если условиться, что масса системы в целом равна 100 г и в составе химического соединения массовое отношение компонентов А и С составляет 1:1, то масса АС
интерес представляет состав твердой фазы, как результата окончательной кристаллизации системы, т.е. состояние системы при температуре чуть ниже, чем точка Е 1. В твердую фазу полностью входят компоненты С (в составе химического соединения) и В. Для точки 1 компонент А находится в избытке по отношению к С и его масса распределяется между составом химического соединения и чистым веществом. Если условиться, что масса системы в целом равна 100 г и в составе химического соединения массовое отношение компонентов А и С составляет 1:1, то масса АС
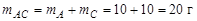 ,
,
и численно равна массовой доле химического соединения в составе твердой фазы; масса компонента А, составляющая отдельную фазу
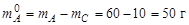 или 50 %.
или 50 %.
 2015-07-04
2015-07-04 1065
1065
