Лабораторная работа №23
1. Цель работы: закрепление теоретических знаний по теме 5.1. “Термодинамическое описание микросистемы” (“Фазовые равновесия и превращения” (Савельев И.В. Курс общей физики, 5-ое изд., гл. 17)). Приобретение практических навыков работ с термостатами и измерения температуры. Изучение принципа работы тепловой машины ТМ-59,
приобретение практических навыков в работе с калориметром и термометрами,
изучение методики расчетов, основанных на уравнении теплового баланса
2. Порядок подготовки к выполнению лабораторной работы: изучить теорию и ознакомиться с оборудованием
3. Порядок выполнения лабораторной работы изложен в упражнениях
4. Подведение итогов выполнения работы
предъявить результаты, подготовка и оформление отчета, заполнить таблички, произвести обработку результатов измерений
5. техника безопасности при выполнении лабораторной работы – обычная лабораторная
Оборудование: калориметр, термометр, мензурка, весы, электроплитка, холодильник.
Теория
Одно и то же вещество в зависимости от условий, в которых оно находится, может быть в различных агрегатных состояниях – газообразном, жидком или кристаллическом. В последнем случае возможны различные модификации.
Совокупность однородных, одинаковых по своим свойствам, частей системы в термодинамике называется фазой. Если, например, в замкнутом сосуде находятся вода, лед и над ними смесь воздуха и паров воды, то в данном случае система состоит из трех фаз: одну фазу образует вода, вторую – лед, третью – смесь воздуха и паров воды. При определенных условиях фазы могут находиться в равновесии друг с другом. Если, например, давление сохраняется постоянным, то устойчивому состоянию каждой фазы соответствует определенный интервал температур. На диаграмме р – Т (рис.4.19) различные состояния равновесия двух фаз изображаются кривой 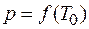 , где Т0 – температура превращения. Равновесие между жидкостью и ее насыщенным паром возможно лишь в температурном интервале между тройной В и критической К точками. Точки кривой
, где Т0 – температура превращения. Равновесие между жидкостью и ее насыщенным паром возможно лишь в температурном интервале между тройной В и критической К точками. Точки кривой 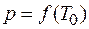 определяют условия, при которых пар находится в равновесии с жидкостью.
определяют условия, при которых пар находится в равновесии с жидкостью.
Пусть в цилиндре под поршнем в темодинамическом равновесии находятся жидкость и ее насыщенный пар. Проведем для этой системы, состоящей из двух фаз, обратимый цикл Карно (рис. 4.20). На участке  при изометрическом расширении, происходящем при температуре Т, система приобретает из внешнего источника теплоту
при изометрическом расширении, происходящем при температуре Т, система приобретает из внешнего источника теплоту  . При этом объем системы увеличивается от V1 до V2. Этот процесс является изометрическим и изобарическим и на диаграмме
. При этом объем системы увеличивается от V1 до V2. Этот процесс является изометрическим и изобарическим и на диаграмме 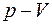 изображается прямой, параллельной оси объемов. На участке
изображается прямой, параллельной оси объемов. На участке 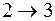 при адиабатическом расширении температура системы понизится на dT, давление – на dp, а объем увеличится на бесконечно малую величину. При изометрическом сжатии на участке
при адиабатическом расширении температура системы понизится на dT, давление – на dp, а объем увеличится на бесконечно малую величину. При изометрическом сжатии на участке 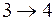 часть пара сконденсируется, выделяющаяся при этом теплота
часть пара сконденсируется, выделяющаяся при этом теплота 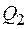 передается холодильнику с температурой Т-dT. На участке
передается холодильнику с температурой Т-dT. На участке 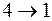 при адиабатическом сжатии объем системы уменьшается на бесконечно малую величину, и система вновь возвращается в начальное состояние, характеризуемой точкой 1. Элементарная работа
при адиабатическом сжатии объем системы уменьшается на бесконечно малую величину, и система вновь возвращается в начальное состояние, характеризуемой точкой 1. Элементарная работа 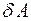 , произведенная за один цикл, численно равна его площади. С точностью до бесконечно малых второго порядка можно считать, что
, произведенная за один цикл, численно равна его площади. С точностью до бесконечно малых второго порядка можно считать, что
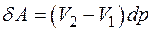 .
.
К.п.д. рассматриваемого обратимого цикла
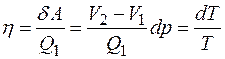 . (4.42)
. (4.42)
Если полагать, что при расширении испарился один моль (или один кг) жидкости, то поступившая из внешнего источника теплота равна молярной (или удельной) теплоте испарения 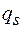 . Для этого случая уравнение (4.42) запишется в виде
. Для этого случая уравнение (4.42) запишется в виде
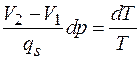 .
.
Отсюда
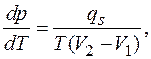 (4.43)
(4.43)
где Т – температура перехода; 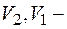 молярные (или удельные) объемы соответственно жидкой и парообразной фаз, или в интегральной форме
молярные (или удельные) объемы соответственно жидкой и парообразной фаз, или в интегральной форме
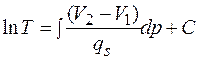 (4.44)
(4.44)
Полученное соотношение, устанавливающее зависимость температуры превращения Т от давления р, при котором протекает процесс, называется уравнением Клапейрона - Клаузиуса. Оно связывает производную от равновесного давления по температуре 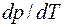 с теплотой превращения
с теплотой превращения 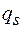 изменением молярного (или удельного) объема
изменением молярного (или удельного) объема 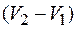 и температурой превращения Т. Вид формул (4.42) – (4.44) не зависит от природы вещества. Поэтому их в равной мере можно применять к любому фазовому превращению однородного вещества: испарению, сублимации, плавлению, полиморфному превращению и др. Заметим, что с изменением температуры изменяются теплота перехода и молярный (или удельный) объем. Поэтому значение производной
и температурой превращения Т. Вид формул (4.42) – (4.44) не зависит от природы вещества. Поэтому их в равной мере можно применять к любому фазовому превращению однородного вещества: испарению, сублимации, плавлению, полиморфному превращению и др. Заметим, что с изменением температуры изменяются теплота перехода и молярный (или удельный) объем. Поэтому значение производной 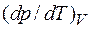 также зависит от температуры. Однако для небольших интервалов температур этим изменением можно пренебречь и
также зависит от температуры. Однако для небольших интервалов температур этим изменением можно пренебречь и 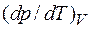 заменить отношением конечных приращений
заменить отношением конечных приращений 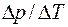 . В этом случае уравнение Клапейрона - Клаузиуса, выражающее связь между изменением температуры и давления при сохранении равновесия в двухфазной системе, примет вид
. В этом случае уравнение Клапейрона - Клаузиуса, выражающее связь между изменением температуры и давления при сохранении равновесия в двухфазной системе, примет вид
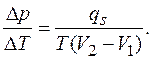
В таком виде это уравнение часто используют для числовых расчетов.
Если считать второй фазой ту, для получения которой требуется теплота, то 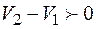 , поскольку объем пара
, поскольку объем пара 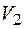 значительно больше, чем объем жидкости
значительно больше, чем объем жидкости 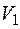 . При этом если
. При этом если 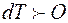 , то и
, то и 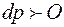 , т.е. с повышением температуры давление насыщенного пара растет, или, другими словами, с повышением давления точка кипения повышается.
, т.е. с повышением температуры давление насыщенного пара растет, или, другими словами, с повышением давления точка кипения повышается.
Когда вещество находится в состоянии, далеком от критического, тогда объем его в жидком состоянии значительно меньше, чем в парообразном. В этом случае, пренебрегая в первом приближении объемом жидкости 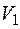 и выражая
и выражая 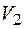 через давление по уравнению Клапейрона – Менделеева
через давление по уравнению Клапейрона – Менделеева 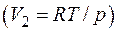 , получим
, получим
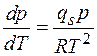 .
.
Отсюда

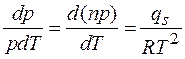 .
.
Интегрируя это выражение в предположении, что 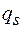 не зависит от температуры, находим
не зависит от температуры, находим
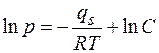 .
.
Потенцируя это равенство, получим
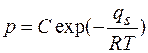 ,
,
где С- постоянная интегрирования с размерностью давления.
Для случая плавления уравнение Клапейрона- Клаузиуса можно записать в виде
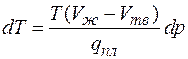 ,
,
где 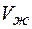 ,
, 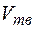 - молярные (или удельные) объемы жидкости и твердого тела;
- молярные (или удельные) объемы жидкости и твердого тела; 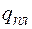 - молярная (или удельная) теплота затвердевания, которая равна, но противоположна по знаку теплоте плавления. Для подавляющего большинства веществ
- молярная (или удельная) теплота затвердевания, которая равна, но противоположна по знаку теплоте плавления. Для подавляющего большинства веществ 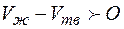 , поэтому при
, поэтому при 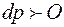 и
и 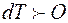 . Следовательно, при повышении давления температура плавления повышается. Однако разность
. Следовательно, при повышении давления температура плавления повышается. Однако разность 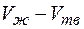 обычно незначительна, поэтому и изменение температуры плавления, как правило, невелико. Однако существуют вещества (вода, висмут, чугун, германий), для которых
обычно незначительна, поэтому и изменение температуры плавления, как правило, невелико. Однако существуют вещества (вода, висмут, чугун, германий), для которых 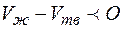 . Для них при
. Для них при 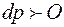
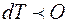 , т.е. при повышении давления точка плавления понижается. В системе пар- твердое тело давление насыщенного пара возрастает при повышении температуры.
, т.е. при повышении давления точка плавления понижается. В системе пар- твердое тело давление насыщенного пара возрастает при повышении температуры.
Упражнение 1.
Определение отношения удельной теплоемкости льда Сл к удельной теплоте плавления льда λ.
Порядок выполнения работы
Работа выполняется в три этапа:
а) определяем теплоемкость калориметра. Для этого заливаем в него подогретую воду массой mв = 200 г. В процессе установления теплового равновесия вода остывает на ∆T0 K. Уравнение теплового баланса имеет вид
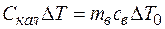 .
.
Калориметр нагревается на ∆Т. Отсюда получим:
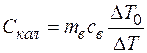 (1)
(1)
Теплоемкость воды считаем неизвестной.
б) Берем из холодильника лед массой mл, и прежде, чем положить его в калориметр, ждем, чтобы он начал подтаивать. При этом начальную температуру необходимого куска льда можно считать равной нулю. Кладем лед в калориметр и заливаем некоторым количеством подогретой воды mB. Уравнение теплового баланса
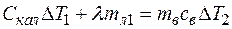 , (2)
, (2)
где ∆Т1 - изменение температуры калориметра, ∆Т2 – изменение температуры подогреваемой воды mВ.
Заливаем такое количество воды mB, чтобы после таянья льда установившаяся температура была равной нулю по Цельсию. При этих условиях справедливо (2).
Из (2) и (1) имеем уравнение
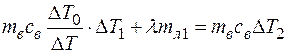 (2’)
(2’)
Здесь неизвестные величины св и λ. Для их определения необходимо провести третий этап работы.
в) включаем все по пункту б), но массу льда 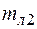 уменьшаем. Тогда
уменьшаем. Тогда
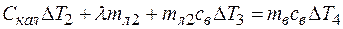 (4)
(4)
здесь ∆T2 – изменение температуры калориметра; 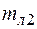 - масса льда; ∆T3 – изменение температуры воды, образовавшейся из льда, ∆T4 – изменение температуры воды, залитой в калориметр. Из (1) и (3) имеем
- масса льда; ∆T3 – изменение температуры воды, образовавшейся из льда, ∆T4 – изменение температуры воды, залитой в калориметр. Из (1) и (3) имеем
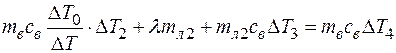 (3’)
(3’)
Решаем (2’) и (3’) соответственно и находим отношение св и λ.
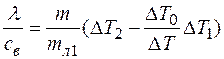
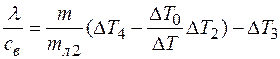
Данные эксперимента заносим в таблицу
| № | mв | mл | mл2 | ΔТ | ΔТ0 | ΔТ1 | ΔТ2 | ΔТ3 | ΔТ4 | λ/св |
2 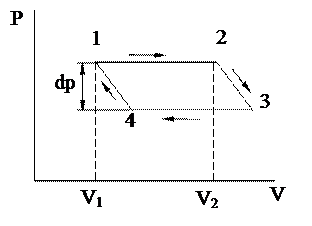
Рис. 1. Цикл Карно для системы, состоящей из двух фаз
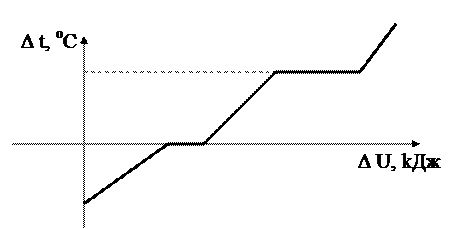
Рис. 2. Диаграмма фазовых переходов
Контрольные вопросы
1. Что такое теплоемкость тела, удельная теплоемкость вещества, молярная теплоемкость вещества?
2. Укажите виды фазовых переходов.
3. Дайте определение скрытой теплоты фазового перехода.
4. Как изменяется энтропия тела при фазовых переходах?
5. Как влияет теплоемкость калориметра на точность определения теплоемкости исследуемых веществ?
6. Остается ли теплоемкость вещества постоянной при изменении температуры?
7. Опишите тепловые процессы, изображенные на рис.2.
Упражнение 2
Изучение физических принципов работы тепловой машины
Тепловая машина ТМ-59 предназначена для удаления ледяных и гололедных образований с бетонных покрытий. Принцип действия машины основан на использовании потока горячих газов, выходящих из сопла реактивного двигателя с высоким скоростным напором.
При воздействии газового потока на обледенелое покрытие при отрицательной температуре воздуха происходит расплавление льда с частичным испарением и сдуванием (смещение) образовавшейся воды в сторону.
При положительной температуре или близкой к 0ºС, когда сцепление льда с покрытием значительно уменьшается, удаление льда может происходить отрывом его от поверхности без расплавления.
Тепловая машина (рис.1) состоит из следующих составных частей: шасси 2, рабочего органа 1, гидросистемы 11, топливной системы 7, управления двигателем ВК-1А 6, установки отопителя 4, установки огнетушителя 5, облицовки 8, установки заземления 9, электрооборудования 3, оборудования дополнительного 10.
В транспортном положении (рис.2). 1 – сцепное устройство, 2 – трос буксирный Е-155.8.61.021.
Машина укомплектована запасными частями, инструментом и принадлежностями, а также радиостанцией.
Кинематическая схема машины показана на рис.3.
Температура выходящего газа не более 540ºС.
Производительность машины – не менее 0,8 га/час (при удалении гололедных образований толщиной до 2 мм и температуре воздуха до - 5ºС).
Использован реактивный двигатель ВК-1А со специальным носадком.
Расход топлива двигателем ВК-1А, кг/ч: при 7000 об/мин турбины – 750; при 9000 об/мин турбины – 960.
Контрольные вопросы
1. По данным техническим характеристикам машины составьте задачу на тепловые процессы и решите ее.
Определение температуры и удельной теплоты плавления кристаллического вещества
Оборудование: пробирка с салолом, термопара, гальванометр, нагреватель, регулятор напряжения, штатив, секундомер.
Введение
Кристаллические вещества переходят из твёрдой фазы в жидкую только при определённой температуре, которая называется температурой плавления. На рис.2.28 показан типичный вид кривой нагревания и охлаждения кристаллического вещества.
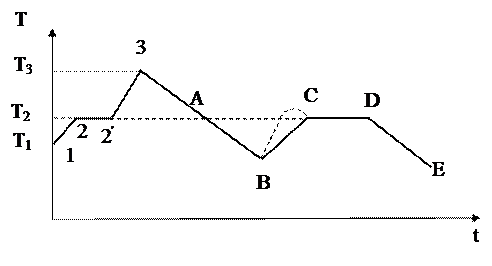
В твердой фазе тело, поглощая энергию, нагревается (участок 1 - 2 кривой), скорость и энергия теплового движения молекул в узлах кристаллической решётки возрастает. При достижении температуры плавления (точка 2) скорость движения молекул становится настолько большой, что их энергия оказывается достаточной для разрыва связей кристаллической решетки; тело начинает плавиться, часть его переходит в жидкую фазу. При дальнейшем поглощении энергии телом средняя скорость молекул образовавшейся жидкой фазы не увеличивается, температура тела не меняется (участок 2 - 2´), поскольку эти молекулы передают энергию от нагревателя к частицам твёрдой фазы, вызывая дальнейшее плавление кристаллического вещества. Поглощаемая при этом энергия идёт на увеличение потенциальной энергии частиц. Дальнейшее увеличение температуры вещества (участок 2 ׳ - 3) становиться возможным после того, как кристаллическое вещество полностью перейдет в жидкую фазу.
Если расплавленное вещество, нагретое до температуры Т3 > ТПЛ (участок 3 – А), то при отсутствии в расплавленном веществе центров кристаллизации (крупинок, пылинок и т.д.) и в спокойном состоянии (без вибраций и сильных толчков) молекулы расплава не могут образовать кристаллических связей с соседними молекулами из-за того, что полная энергия этих молекул больше, чем энергии связи. Для того чтобы могла начаться кристаллизация, необходимо уменьшить энергию молекул. Это достигается некоторым переохлаждением расплавленного вещества (участок А - В). Процесс кристаллизации (начало в точке В) развивается настолько быстро, что энергия, которая выделяется при кристаллизации, вызывает нагрев вещества (участок В - С). Кристаллизация замедляется, и только при температуре Т2 = ТПЛ наступает равновесие: количество теплоты, отданное в окружающую среду, равно количеству теплоты, которое выделяется при кристаллизации. Процесс кристаллизации продолжается (участок С - D).
Иногда при кристаллизации переохлажденного расплава происходит разогрев вещества до температуры более высокой, чем ТПЛ (штриховая кривая В - С). После окончания процесса кристаллизации (точка D) образовавшаяся твёрдая фаза начинает остывать (участок D - Е). Из сказанного следует, что температура плавления кристаллического вещества равна температуре его кристаллизации (ТПЛ = ТКР = Т2).
 2015-07-04
2015-07-04 705
705







