делают зависимыми (закрепляют, связывают) К(Ф — 1) переменных. Число переменных, которые остались независимыми равно:
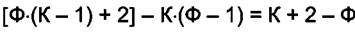
Таким образом, можно произвольно задавать значения К + 2 — Ф переменных не разрушая систему, т.е. не изменяя числа фаз. Число степеней свободы многофазной системы  равно
равно
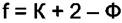 (4.2)
(4.2)
Равенство (4.2) называется правилом фаз Гиббса.  - это число обобщённых сил
- это число обобщённых сил 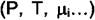 , которые можно произвольно менять не
, которые можно произвольно менять не
изменяя числа фаз. Число степеней свободы многофазной системы может быть равно 0 или быть положительным. Тогда из (4.2) имеем
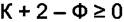 >
> 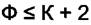
Последнее равенство означает, что в равновесной системе число фаз может превышать число компонент
Нужно более точно определить понятия "компонент" и "фаза". Если в системе не идут реакции, то количество компонент равно числу веществ в системе. Если идут реакции, то число компонент -это минимальное число веществ 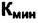 , из которых можно построить систему. Поясним это подробнее. Рассматривая многофазную систему, в которой происходят химические превращения, необходимо учитывать также число уравнений, описывающих химические равновесия. Это уравнения связи концентраций реагирующих веществ через константу равновесия и возможные уравнения материального баланса. Эти дополнительные уравнения надо вычесть из правой части уравнения (4.2). Но, чтобы не изменять способа записи правила фаз для многофазных систем без реакций и с реакциями, число компонентов определяют уравнением
, из которых можно построить систему. Поясним это подробнее. Рассматривая многофазную систему, в которой происходят химические превращения, необходимо учитывать также число уравнений, описывающих химические равновесия. Это уравнения связи концентраций реагирующих веществ через константу равновесия и возможные уравнения материального баланса. Эти дополнительные уравнения надо вычесть из правой части уравнения (4.2). Но, чтобы не изменять способа записи правила фаз для многофазных систем без реакций и с реакциями, число компонентов определяют уравнением
|
|
|
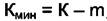
где m - число химических реакций и уравнений материального баланса, 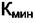 - минимальное число веществ, необходимых для построения системы. Тогда правило фаз в виде (4.2) может быть переписано в виде
- минимальное число веществ, необходимых для построения системы. Тогда правило фаз в виде (4.2) может быть переписано в виде
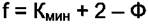 (4.3)
(4.3)
Уравнение (4.3) можно использовать для многофазных систем, как без реакций, так и при их наличии. В данном случае число компонентов может не совпадать с числом сортов молекул, составляющих систему.
Приведём простой пример.
1)Система задаётся напуском произвольных количестви 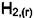 .
. 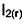 Идёт реакция
Идёт реакция
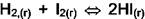 , дополнительное уравнение в равновесии
, дополнительное уравнение в равновесии 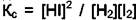 Тогда
Тогда 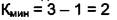
2) Система задаётся напуском произвольного количества 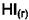 . Идёт реакция
. Идёт реакция
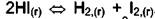 . В этом случае появляется два дополнительных уравнения:
. В этом случае появляется два дополнительных уравнения: 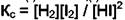 и
и 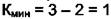 уравнение материального баланса
уравнение материального баланса 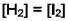 т.е. m = 2.Тогда
т.е. m = 2.Тогда
Фаза - сумма гомогенных частей гетерогенной системы, которые обладают одинаковыми термодинамическими характеристиками и химическим составом и отделёны поверхностью раздела от других фаз.
Максимальное число фаз в равновесной системе реализуется при величине f = 0. В однокомпонентной системе 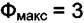 , если К = 2, то
, если К = 2, то
Фмакс = 4.
Если допустить, что один из компонентов отсутствует в одной из фаз,
то это не отразится на числе степеней свободы. Исчезнет одно из
|
|
|
уравнений 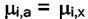 , но одновременно необходимо ввести условие
, но одновременно необходимо ввести условие
отсутствия "i" в фазе Х, т.е. 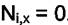 . Общее число уравнений при этом
. Общее число уравнений при этом
останется неизменным, и правило фаз сохранит свою форму. Например, газовая фаза не содержит солевых компонент.
В случае, если рассматривается система только из конденсированных фаз (ж. или ж. + т.), давление столь слабо влияет на объёмы фаз и распределение компонент по фазам, что это не влияет на превращения в системе. В этом случае правило фаз Гиббса записывается так
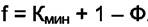 (4.4)
(4.4)
Правило фаз неприменимо в критической точке однокомпонентной системы. В критической точке состояние системы характеризуется единственными значениями 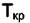 и
и 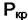 и система не имеет степеней свободы, т. е. f = 0. Но при К = 1 из (4.2) следует, что Ф = 3. Для критического состояния очень существенными становятся поверхностные эффекты (σмф→0
и система не имеет степеней свободы, т. е. f = 0. Но при К = 1 из (4.2) следует, что Ф = 3. Для критического состояния очень существенными становятся поверхностные эффекты (σмф→0 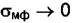 при подходе к критической точке) и
при подходе к критической точке) и
не соблюдается второе ограничение на систему, введённое при выводе правила фаз.
 2015-07-04
2015-07-04 307
307








