Лекция 1
ФAЗОВЫЕ РАВНОВЕСИЯ В ОДНОКОМПОНЕНТНЫХ
СИСТЕМАХ.
4.1. Условие равновесного распределения компонента между
фазами.
4.2. Правило фаз Гиббса.
4.3. Фазовые переходы в однокомпонентной системе. Уравнение
Клапейрона - Клаузиуса.
ФAЗОВЫЕ РАВНОВЕСИЯ В ОДНОКОМПОНЕНТНЫХ
СИСТЕМАХ
Равновесие, для достижения которого необходимо изменение лишь межмолекулярных взаимодействий в системе, называется физическим равновесием. К числу таких можно отнести равновесия в гетерогенных системах: пар - жидкость, пар - твёрдое тело, жидкость - твёрдое тело, две кристаллические модификации. Если такая система содержит только одно вещество, то речь идёт о фазовых равновесиях в однокомпонентной системе. Физическая адсорбция, распределение растворённого вещества между несмешивающимися жидкостями, растворение газа, жидкости, твёрдого тела в другой жидкости тоже приводят к достижению физического равновесия в термодинамической системе, содержащей два и более веществ.
4.1. Условие равновесного распределения компонента между фазами
Напомним из прошлого семестра введение химического потенциала:
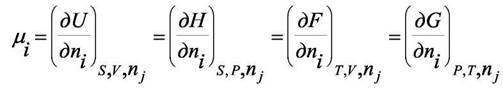
где 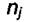 - условие постоянства количества молей всех веществ "j" в
- условие постоянства количества молей всех веществ "j" в
системе кроме вещества "i". Величина µi получила название химического потенциала. Все определения химического потенциала в написанной формуле эквивалентны. Однако в химической термодинамике обычно используют определение
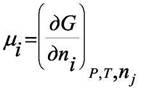
поскольку процессы, связанные с изменением состава изучаются чаще всего при Р и Т = const. При бесконечно малом изменении состава системы в случае Р и Т = const имеем
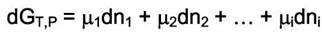
Если состав системы не меняется, то 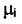 = const и интегральная форма уравнения принимает вид
= const и интегральная форма уравнения принимает вид
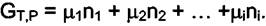
Константа интегрирования в последней формуле равна нулю, так как при 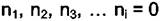 величина
величина 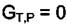 . Из этого уравнения следует,
. Из этого уравнения следует,
что величина ца характеризует вклад, который вносит каждое из веществ в суммарный термодинамический потенциал системы. В случае смесей идеальных газов или чистого вещества химический потенциал индивидуального вещества равен мольному значению свободной 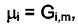 энергии Гиббса
энергии Гиббса  этого вещества:
этого вещества:
Учитывая принятые условия для начала отсчёта величины 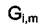 значение химического потенциала индивидуального вещества в стандартных условиях (Р = 1 атм, Т = 298,15 К) равно
значение химического потенциала индивидуального вещества в стандартных условиях (Р = 1 атм, Т = 298,15 К) равно
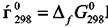
Величины 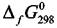 ∆fG2908можно найти в справочных изданиях. Следует
∆fG2908можно найти в справочных изданиях. Следует
отметить, что в общем случае 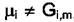 , так как значение химического
, так как значение химического
потенциала 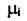 зависит от состава системы, что связано с существованием взаимодействия между молекулами веществ, образующих систему.
зависит от состава системы, что связано с существованием взаимодействия между молекулами веществ, образующих систему.
Теперь перейдём к основному вопросу этого параграфа. Рассмотрим систему, состоящую из нескольких фаз, содержащих различные вещества. Система находится в равновесии при Р = const и Т = const. Предположим, что в этих условиях небольшое количество  вещества
вещества 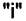 переходит из фазы
переходит из фазы 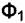 в фазу
в фазу 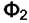 , причём равновесие в системе сохраняется.
, причём равновесие в системе сохраняется.
Условие равновесия при Р и Т = const, это постоянство термодинамического потенциала системы, т.е.
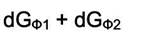
|
= 0,
или
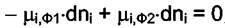
откуда
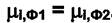 (4.1)
(4.1)
Таким образом, условие равновесия двух фаз 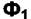 и
и 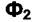 по
по
|
| отношению к веществу I - равенство химических потенциалов |
|
вещества I в обеих фазах. Если химический потенциал вещества 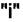 в фазе
в фазе 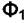 не равен химическому потенциалу того же вещества в фазе
не равен химическому потенциалу того же вещества в фазе 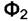 , то вещество будет переходить из одной фазы в другую. Такой процесс будет самопроизвольным. Он приближает систему к равновесию.
, то вещество будет переходить из одной фазы в другую. Такой процесс будет самопроизвольным. Он приближает систему к равновесию.
При Р и Т = const в самопроизвольном процессе потенциал Гиббса системы должен уменьшаться, т. е.
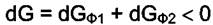
Если малое количество dni вещества 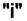 переходит из фазы
переходит из фазы 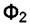 в фазу
в фазу 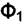 ,то
,то
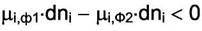
что соответствует неравенству
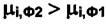 ■
■
Следовательно, вещество 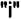 самопроизвольно переходит из фазы с более высоким значением химического потенциала в фазу, где его химический потенциал ниже. Этот процесс продолжается до выравнивания химических потенциалов вещества
самопроизвольно переходит из фазы с более высоким значением химического потенциала в фазу, где его химический потенциал ниже. Этот процесс продолжается до выравнивания химических потенциалов вещества 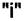 в обеих фазах.
в обеих фазах.
 2015-07-04
2015-07-04 346
346