Физико-химические свойства и структура воды
Вода играет исключительную роль в биологических объектах благодаря уникальным физико-химическим свойствам, которые определяются строением ее молекулы и обусловленной этим строением особой структурой.
Молекулярное строение воды. Молекула воды, состоящая всего из трех атомов, представляет собой диполь, так как центры отрицательных и положительных зарядов в ней не совпадают. Подобная ассиметрия объясняется следующими обстоятельствами(рис. 1).
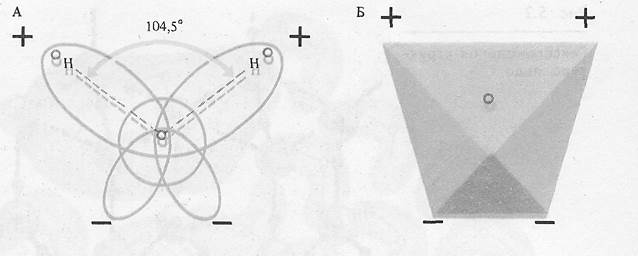
Рис. 1. Схема расположения атомов (А) и избыточных зарядов (Б) в молекуле воды
В молекуле воды две пары электронов являются общими для ядер водорода и кислорода. Они имеют сильно вытянутые орбиты и несут частично положительные заряды, так как атом кислорода притягивает электроны от атома водорода. Две другие пары электронов кислорода остаются неподеленными. Они движутся по менее вытянутым элиптическим орбитам, направленным в противоположные стороны. Поэтому эта часть молекулы имеет отрицательный заряд. Электрическая поляризация молекулы усиливается тем, что орбиты с неподеленными электронами атома кислорода лежат в плоскости, перпендикулярно плоскости молекулы, а угол между ядрами водорода составляет 104,50, то возникает структура тетраэдра с четырьмя полюсами электрических зарядов. Поэтому молекула воды с такой структурой может взаимодействовать с четырьмя другими молекулами воды за счет электростатического взаимодействия. Такие связи могут возникать и с электроотрицательными атомами кислорода и азота, находящимися в составе биополимеров, что оказывает существенное влияние на конформацию и функции последних. Такое электростатическое взаимодействие с незначительной долей ковалентности называется водородной связью. Ее энергия равна 18,84 кДж/моль. Это сравнительно слабая связь. К примеру, энергия ковалентной связи Н – О в молекуле воды составляет 460,4 кДж/моль. Водородные связи непрерывно возникают и разрушаются. Время полужизни каждой из них – менее 1•10-9 с.
Структура воды. До настоящего времени, несмотря на интенсивные исследования, окончательно не выяснены особенности структуры воды в различных ее состояниях. В зависимости от времени жизни различают три типа структуры жидкой воды:
1. структура (I), существующая в течение времени, меньшего, чем период осцилляций (колебаний от равновесия) молекул (<2•10-13 с);
2. структура (V), существующая в течение времени большего, чем период осцилляций, но меньшего, чем период диффузионных движений молекул (>2•10-13 с, <10-11 с);
3. структура (D), существующая в течение времени большего, чем период диффузионных движений молекул (>10-11 с).
Разрешающая способность большинства методов (рентгенография, ЯРМ, термодинамический анализ) позволяет получить информацию лишь о третьей структуре. Инфракрасная и рамановская 
 спектроскопия, неупругое рассеяние нейтронов способны давать информацию о V-структуре.
спектроскопия, неупругое рассеяние нейтронов способны давать информацию о V-структуре.
Обычно время жизни структуры жидкой воды принимается за 10-11 с, то есть равным периоду диффузионных движений молекул. Через каждые 10-11 с данная структура нарушается диффузионным движением хотя бы малой части молекул и сразу возникает вновь. Новая структура может отличаться от предыдущей пространственным расположением, координационным числом молекул, энергией Н-связей.
Тетраэдрическая координация молекул воды служит основой для гексагональной кристаллической структуры льда (рис. 2), где в центре тетраэдра располагается молекула воды, связанная четырьмя водородными связями с молекулами воды, расположенными в вершинах тетраэдра. Среднее

Рис. 2. Гексагональная структура льда
расстояние между атомами кислорода для льда составляет 0,276 нм. При плавлении льда резко возрастает тепловое движение молекул, которое способствует разрыву (или искажению) части водородных связей (~50%). В результате частично нарушается кристаллическая решетка. Выпавшие из решетки молекулы воды более уплотненно располагаются в ее полостях. Вследствие этого при плавлении увеличивается плотность и уменьшается объем воды.
Существует ряд моделей строения жидкой воды:
1. По представлениям О.Я. Самойлова (1957) жидкая вода имеет однородную (ажурную) льдоподобную структуру, в пустотах гексагонального каркаса которой располагаются мономерные молекулы воды, не имеющие или имеющие малое число водородных связей. Трансляционное движение молекул воды происходит в основном по полостям каркаса.
2. Кластерная модель представляет равномерную смесь льдоподобных образований и мономерных молекул воды, где водородные связи отсутствуют или реализованы лишь частично (рис. 3). Кластеры (или рои) – это скопления молекул, объединенных Н-связями. Время жизни кластеров 10-10 ─ 10-11 с. «Мерцающие кластеры» возникают и исчезают вследствие локальных энергетических флуктаций (отклонений от среднего). В каждый данный момент времени в образовании «мерцающих кластеров» участвует до 2/3 молекул воды.
3. Модель искаженных водородных связей предполагает, что водородные связи при плавлении льда не разрываются, а лишь искажаются. При этом меняется их изгиб, что сопровождается изменением угла между линией, соединяющей центры соседних молекул, и направлением Н-связи между этими молекулами. По мнению Эйзенберга и Кауцмана (1975), эта модель находится в согласии с большинством экспериментальных данных о структуре воды. Однако наиболее распространенными пока остаются две первые модели.
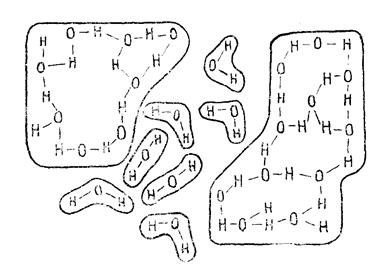
Рис. 3. Модель кластерной структуры жидкой воды.
Структура воды претерпевает существенные изменения в зависимости от внешних условий. При повышении температуры усиливается тепловое движение молекул, вследствие чего сокращается доля льдоподобной структуры (доля молекул, входящих в кластеры) и возрастает доля плотноупакованной структуры (или мономерных молекул) (табл. 1, 2).
Таблица 1. Количество молекул воды (молярные проценты) в льдоподобных структурах и их пустотах и доля заполнения пустот в зависимости от температуры (по Блоху, 1969)
| Температура, 0С | Пустоты | Каркас | Доля заполнения пустот, % | Температура, 0С | Пустоты | Каркас | Доля заполнения пустот, % |
| 0,137 0,162 0,187 0,213 | 0,863 0,838 0,813 0,787 | 31,7 38,7 46,0 54,1 | 0,238 0,263 0,288 0,33(3) | 0,762 0,737 0,712 0,66(6) | 62,5 71,0 80,9 100,0 |
Таблица 2. Температурная зависимость структурных параметров жидкой воды (по Хорну, 1972)
| Температура, 0С | Среднее количество молекул Н2О в кластере | Концентрация кластеров (мольная доля) | Мольная доля мономерной воды | Доля неразорванных Н─связей |
| 64,96 38,37 24,29 16,64 13,14 11,70 | 0,0084 0,0124 0,0172 0,0198 0,0257 0,0268 | 0,2485 0,2948 0,3394 0,3773 0,4095 0,4375 | 0,528 0,462 0,409 0,370 0,344 0,325 |
Данные таблиц 1, 2 создают впечатление о монотонности изменений структуры воды при повышении температуры. Однако есть данные, показывающие микрофазные переходы воды при температурах 150, 300, 450, 600 и сопутствующие им изменения некоторых биологических процессов. Так, Фрейдин и Бочков (1976) констатируют, что в середине интервала 30-450 структура воды наиболее благоприятна для гидратации органических молекул, в частности белков. Структура воды зависит не только от температуры, но и от давления. С повышением давления возрастает химический потенциал и активность воды, то есть увеличивается подвижность ее молекул (фактор, разрушающий структуру). Основным видом давления, действующего на воду клеток растения, является тургорное давление, увеличение которого повышает активность внутриклеточной воды.
Физико-химические свойства воды. Структурированностью воды объясняются ее уникальные физико-химические свойства. Вода – самое аномальное вещество, хотя принята за эталон меры плотности и объема для других веществ.
Плотность. Все вещества увеличивают объем при нагревании, уменьшая при этом плотность. Однако у воды при давлении 1 атм (0,1013 МПа) увеличение температуры от 0 до 40Собъем уменьшается и максимальная плотность наблюдается при 40С – 1 см2 воды имеет массу 1 г. При замерзании объем воды резко возрастает (на 11%), а при таянии льда при 00С – резко уменьшается. С увеличением давления температура замерзания воды понижается через каждые 130 атм. (13,17 МПа) на 10С. Поэтому на больших глубинах при отрицательных температурах вода в океане не замерзает.С увеличением температуры до 1000С плотность жидкой воды понижается на 4% (при 40С плотность ее равна 1).
Точка кипения и замерзания. При давлении в 1 атм. точка кипения равна 1000С, а замерзания 00С. Это резко отличает воду от соединений водорода с элементами VI группы Периодической системы Менделеева. В ряду H2Te, H2Se, H2S и т.д. с увеличением молекулярной массы точки кипения и замерзания этих веществ повышаются. Поэтому вода (Н2О) должна бы иметь точку кипения между 75 и 1000С, замерзания: (-90) – (-120)0С. С увеличением давления температура кипения воды возрастает, а замерзания – падает.
Скрытая теплота кипения и плавления. Скрытая теплота плавления льда очень высокая – 335 Дж/г (для серы - 40). Поэтому лед при нормальном давлении имеет температуру от -1 до -70С. Скрытая теплота парообразования воды почти в семь раз выше скрытой теплоты плавления и равна 2,3 кДж/г.
Теплоемкость. Теплоемкость – это количество теплоты, необходимое для повышения температуры на 10С. Она в 5-30 раз выше у воды, чем у других веществ. Удельная теплоемкость воды при 160С условно принята за единицу, служа эталоном для других веществ. Поскольку теплоемкость песка в 5 раз меньше, чем у жидкой воды, то вода в водоеме нагревается в 5 раз слабее, чем песок на берегу, но во столько же раз дольше сохраняет теплоту. Высокая теплоемкость воды защищает растения от резкого повышения температуры при высокой температуре воздуха. Высокая теплота парообразования участвует в теплорегуляции у растений.
Поверхностное натяжение и прилипание. На поверхности воды за счет когезии молекул создается поверхностное натяжение. Величина его при 180С составляет 0,72 мН/см (выше только у ртути – 5 мН/см). Благодаря силам сцепления по поверхности водоемов передвигаются водяные жуки. В тропиках ящерицы-василиски (размером до 50 см) пробегают с разбега на задних лапах 10-12 м по водной глади, а затем начинают плыть. Вода обладает также свойством адгезии (смачивания, прилипания), которое обнаруживается при ее подъеме против сил гравитации. Силы сцепления имеют решающее значение при поднятии воды в капиллярах (выше ее исходного уровня). Это хорошо наблюдается в сосудах стебля.
Вода как растворитель. Полярность молекулы воды обуславливает ее свойство растворять вещества лучше, чем другие жидкости. При диссоциации воды образуются ионы водорода (Н+) и гидроксила (ОН-), но протон водорода немедленно гидратируется молекулой воды, образуя ион гидроксония: Н+ + Н2О ↔ Н3О
Суммарная реакция диссоциации такова: 2Н2О ↔ Н3О+ + ОН-, где Н3О+ обычно обозначают как Н+.
При 250С концентрация Н+ и ОН- в чистой воде составляет 1*10-7 моль/л, что соответствует рН 7. Растворение неорганических солей осуществляется благодаря гидратации ионов. Хорошо растворяются в воде органические вещества с карбоксильными, гидроксильными, карбонильными и с другими группами которых вода образует водородные связи.
В таблице 3 представлены биологические процессы и явления, которые определяются уникальными свойствами воды.
Таблица 3. Значение свойств воды для биологических процессов и явлений (по Пильщиковой, 1993)
| № | Свойства воды | Значение |
| 1. | Высокая теплоемкость и скрытая теплота парообразования | Поддерживает тепловой баланс растений |
| 2. | Высокое поверхностное натяжение | Определяет передвижение воды по капиллярам, обуславливает большие значения поверхностных явлений в водных системах, в том числе биологических |
| 3. | Высокая растворяющая способность | Важно для корневого питания растений, передвижения продуктов фотосинтеза, транспорта О2 и СО2 |
| 4. | Структурироваемость, обеспечиваемая водородными связями | Обуславливает аномальные свойства воды, делает воду структурным компонентом цитоплазмы, играет роль в процессах анестезии |
| 5. | Взаимодействие с биополимерами | Влияет на конформацию биополимеров и активность ферментов, определяет степень устойчивости растений к неблагоприятным условиям |
| 6. | Диссоциация на высокоактивные ионы 2Н2О ↔ Н3О + ОН-, Кw = 10-14 | Участвует в химических реакциях (фотосинтеза, дыхания, гидролиза) |
| 7. | Поглощение инфракрасной радиации, сравнительная прозрачность для видимой части спектра | Обеспечивает способность водных растений поглощать фотосинтетически активную радиацию (ФАР), прозрачные клетки эпидермиса наземных растений пропускают ФАР к мезофиллу и, в како-то мере, предотвращают его перегрев |
 2015-07-03
2015-07-03 3650
3650







