Применим неравенство (44) к изолированной системе, которая никак не взаимодействует с окружающей средой. Поскольку для такой системы δ Q = 0, то (44) принимает вид:
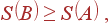
| (45) |
т.е. для любого процесса в изолированной системе энтропия конечного состояния не может быть меньше энтрпии начального состояния. Это – закон возрастания энтропии.
Если процесс обратим, то в (45) стоит знак равенства, т.е. энтропия системы не меняется.
Закон возрастания энтропии справедлив только для изолированных систем. С помощью внешней системы можно уменьшить энтропию тела. Однако суммарная энтропия тела и внешней системы уменьшиться не может.
Если изолированная система находится в состоянии с максимальной энтропией, сооответствующей ее энергии, то в ней не могут происходить никакие процессы, поскольку любой процесс привел бы к уменьшению энтропии. Таким образом, состояние с максимальной энтропией является наиболее устойчивым состоянием изолированной системы.
Самопроизвольные процессы в изолированных системах идут в направлении роста энтропии. Продемонстрируем это двумя примерами.
1. Рассмотрим теплообмен между двумя частями системы A 1 и A 2, имеющими температуры T 1 и T 2. Пусть T 1< T 2. Теплота передается от горячего тела к холодному. Поэтому тело A 2 передаст телу A 1 некоторое количество теплоты Q, т.е.
| Δ Q 1 = Q, Δ Q 2 = – Q. |
При этом энтропия тела A 1 изменится на величину Δ Q 1/ T 1, а энтропия тела A 2 – на величину Δ Q 2/ T 2. Общее изменение энтропии системы
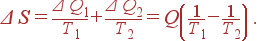
| (46) |
Поскольку T 1< T 2, то Δ S >0.
2. Рассмотрим теперь выделение теплоты при трении. Энтропия тела, которое нагревается при трении, возрастает. Это увеличение энтропии не компенсируется уменьшением энтропии других частей системы, так как теплота получена из работы.
 2015-07-03
2015-07-03 348
348







