При выполнении химического анализа часто возникает необходимость провести реакцию при неизменном определенном значении рН раствора. В этом случае используют буферные растворы, способные сохранять некоторое время постоянным значение рН при добавлении в раствор сильных кислот (например, HCl), щелочей (например, NaOH) и при разбавлении раствора. Обычно буферный раствор представляет собой смесь слабой кислоты и ее соли (кислотная буферная система с рH < 7), слабого основания и его соли (основная буферная система, c pH > 7), или смеси кислых и средних солей.
Механизм буферного действия рассмотрим на примере ацетатного буфера.
Он основан на смещении положения равновесия реакции диссоциации слабой кислоты:
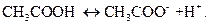 (1)
(1)
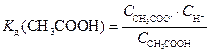 (2)
(2)
В присутствии сильного электролита CH3COONa, полностью диссоциированного в растворе:
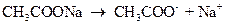 , (3)
, (3)
равновесие (1) сильно сдвинуто влево, поэтому концентрация недиссоциированных молекул СН3СООН практически равна концентрации кислоты, а концентрация ионов СН3СОО- равна концентрации соли:
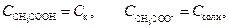
Для разбавленного раствора константу диссоциации Kд в смеси с CH3COONa можно выразить через равновесные концентрации кислоты и соли:
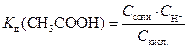 , (4)
, (4)
и после логарифмирования уравнения (4) получаем зависимость рН от концентрации соли и кислоты.
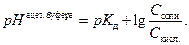 (5)
(5)
где 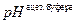 =
= 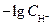 ,
,
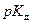 = –lg K д.
= –lg K д.
Для уксусной кислоты значение 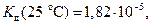 тогда
тогда 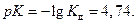
Буферный эффект ацетатного буферного раствора связан с тем, что при добавлении к этому раствору сильной кислоты (например, HCl) избыток ионов водорода, возникающий в растворе как результат диссоциации сильной кислоты,
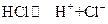
связывается анионом слабой (малодиссоциирующей) уксусной кислоты 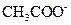 , так что
, так что
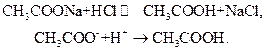
При добавлении щелочи (например, NaOH) гидроксид-ионы ОН- нейтрализуются уксусной кислотой с образованием слабого электролита – воды в результате реакции нейтрализации:
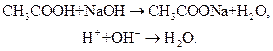
В обоих случаях концентрация ионов водорода и гидроксид-ионов в растворе практически не изменяется, то есть сохраняется исходное значение рН.
Аммиачный буферный раствор представляет смесь гидроксида аммония и хлорида аммония. Для аммиачного буфера зависимость pH определяется уравнением (6):
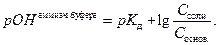 (6)
(6)
Для гидроксида аммония 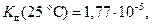 тогда
тогда 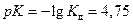 .
.
При добавлении к такому раствору кислоты или щелочи происходит нейтрализация ионов водорода или связывание гидроксид-ионов в слабый электролит – гидроксид аммония 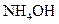 (по современным представлениям – в гидрат аммония
(по современным представлениям – в гидрат аммония 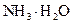 ):
):
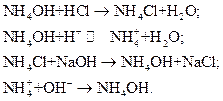
При этом сохраняется значение рН исходного раствора.
При разведении водой буферные системы сохраняют постоянство рН благодаря сохранению равновесия между кислотой и сопряженным основанием, которое определяется постоянством константы диссоциации слабой кислоты или слабого основания.
Из уравнений следует, что рН буфера не изменится при разбавлении. Однако значительное уменьшение концентрации буферного раствора приведет к увеличению степени диссоциации слабого электролита согласно (2), поэтому рН буфера при сильном разбавлении изменится.
Буферные системы характеризуются двумя параметрами:
1. Значение создаваемого этими растворами рН;
Значение рН в буферных системах определяется величиной константы диссоциации слабой кислоты или слабого основания: в кислотных буферных системах (слабая кислота + ее соль) –соотношением концентрации слабой кислоты С кисл и ее соли С соли; в основных буферных системах (слабое основание + его соль) – соотношением концентрации слабого основания С осн и его соли С соли.
2. Буферная емкость.
Буферное действие отличающихся по составу буферных смесей неодинаково. Важной величиной, которая характеризует способность буферной системы противодействовать изменению реакции среды (т.е. изменению ее рН) при добавлении кислот или щелочей, является буферная емкость системы.
Буферной емкостью раствора называют количество молей кислоты или щелочи, которые при прибавлении к одному литру (1 дм3) буферного раствора изменяют его рН на единицу.
Буферную емкость можно определить экспериментально или рассчитать.
Способность буферных систем поддерживать постоянное значение рН небезгранична, она зависит от качественного состава системы и концентрации компонентов. При добавлении к буферной системе значительных количеств сильной кислоты или сильного основания наблюдается заметное изменение рН.
Величину буферной емкости системы по кислоте или по щелочи рассчитывают по формуле:
 (7)
(7)
где С и V – концентрация и объем добавленной кислоты или щелочи к буферному раствору с объемом V буфера, 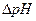 – изменение pH после добавления кислоты или щелочи.
– изменение pH после добавления кислоты или щелочи.
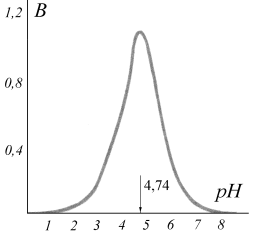 Рис.1. Зависимость буферной емкости ацетатной системы от pH системы. Рис.1. Зависимость буферной емкости ацетатной системы от pH системы. | Буферная емкость зависит от соотношения концентраций компонентов буферной системы, а, следовательно, и от рН буфера. Типичный график зависимости буферной емкости от рН на примере ацетатной системы приведен на рис. 1. Максимальная буферная емкость соответствует значению рН = рК = 4,74. При рН = рК отношение Ссоли/Скисл. = 1, т.е. в системе содержатся одинаковые количества соли и кислоты. При таком соотношении концентраций компонентов системы ее рН изменяется в меньшей степени, чем при других отношениях, следовательно, буферная емкость максимальна при равных концентрациях компонентов буферной системы и уменьшается с отклонением от этого соотношения. |
Из рис. 1 следует и другой важный вывод: рабочий участок буферной системы, т.е. способность противодействовать изменению рН при добавлении кислот и щелочей, имеет протяженность приблизительно в одну единицу рН с каждой стороны от точки рН = рКА. Вне этого интервала буферная емкость быстро снижается. Интервал 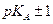 называется зоной буферного действия.
называется зоной буферного действия.
Буферные системы широко распространены в природе. Например, кровь человека имеет постоянное значение рН» 7,4, создаваемое специальной буферной системой крови. Буферные растворы широко применяются в качественном и количественном анализе для создания и поддержания определенного значения рН среды при проведении реакций. Например, ионы Ва2+ отделяют от ионов Са2+ и Sr2+ дихромат-ионами 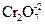 в присутствии ацетатного буферного раствора. Цветные качественные реакции с органическими индикаторами так же выполняют при строго определенных значениях рН. Например, фенолфталеин изменяет окраску с малиновой на бесцветную, а метиловый оранжевый изменяет окраску с желтой на красно-оранжевую при переходе рН > 7 к pH < 7. Для определения жесткости водных сред используемый индикатор хромоген синий изменяет свою окраску в точке эквивалентности только в среде с рН = 9.
в присутствии ацетатного буферного раствора. Цветные качественные реакции с органическими индикаторами так же выполняют при строго определенных значениях рН. Например, фенолфталеин изменяет окраску с малиновой на бесцветную, а метиловый оранжевый изменяет окраску с желтой на красно-оранжевую при переходе рН > 7 к pH < 7. Для определения жесткости водных сред используемый индикатор хромоген синий изменяет свою окраску в точке эквивалентности только в среде с рН = 9.
 2015-07-02
2015-07-02 11658
11658
