| № буферной смеси | |||||||
| Vсоли/Vкисл | |||||||
| lg(Vсоли/Vкисл.) | |||||||
| рН расч. | |||||||
| рН изм. | |||||||
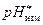 после добавления кислоты после добавления кислоты | |||||||
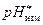 после добавления щелочи после добавления щелочи | |||||||
| Буферная ёмкость по кислоте | |||||||
| Буферная ёмкость по щелочи |
Таблица 3
Влияние разбавления буферного раствора водой
| Концентрация буферного раствора | |||||||
| рН изм. |
4. Запишите выводы по работе и ответьте на контрольные вопросы.
Вопросы для самоконтроля
1. При каком значении рН буферная емкость аммиачного буфера максимальна?
2. Объясните, почему при сильном разбавлении значение рН буфера не остается постоянным (рН увеличится или уменьшится)?
3. Запишите кислотно-основное равновесие для аммиачного буфера. Выведите зависимость рН буфера от соотношения компонентов.
4. Из каких компонентов состоит ацетатный буферный раствор, какая реакция произойдет при добавлении к нему едкого натра? Как при этом изменится рН?
5. Укажите зоны действия ацетатного и аммиачного буферов.
6. Показать механизм буферного действия ацетатной буферной системы при добавлении к ней раствора соляной кислоты. Как изменится рН после добавления HCl?
Литература:
1. Лабораторный практикум по физической химии: Учеб. пособие для вузов/ В.А.Хомич, С.А.Эмралиева. – Омск: Изд-во СибАДИ, 2009. – 38 с.
2. Буферные растворы: Метод указ./Сост. Н. И. Ульянова, Г. Н. Олисова – Великий Новгород, НовГУ им. Ярослава Мудрого, 2006, 7 стр.
3. Лазарев А.И., Харламов И.П., Яковлев П.Я., Яковлева Е.Ф. Справочник химика-аналитика. – М.: Металлургия, 1976. – 184 с.
4. Гурвич Я.Я. Химический анализ: учебник для средн. учебн. заведений профтехобразования. – М.: Высшая школа, 1985. – 295 с.
5. Шретер В., Лаутеншлегер К.-Х., Бибрак Х. Химия: Справочное издание. – Пер. с нем. 2-е изд. – М.: Химия, 2000. – 648 с.
Приложение
Измерение рН с помощью приборов
В настоящее время основным методом измерения рН является использование специального прибора – рН-метра.
 Рис. 2. Используемый в работе pH–метр. Рис. 2. Используемый в работе pH–метр. | Принцип действия такого прибора потенциометрический, то есть измеряемой величиной является напряжение между двумя электродами, опущенными в раствор. Обычно напряжение между такими электродами изменяется на десятки и сотни милливольт. |
Таким образом, рН–метр представляет собою милливольтметр. Особенностью такого милливольтметра является очень маленький входной ток, так что он может измерять напряжение с самых разных электродов, в том числе стеклянных, через который большой ток не проходит. Кроме того, у рН-метра имеется система пересчета напряжения в рН (а в более совершенных моделях и в некоторые другие величины).
 2015-07-02
2015-07-02 1205
1205
