ВВЕДЕНИЕ
Коллоидная химия – наука о физико-химических свойствах дисперсных систем и поверхностных явлений.
В 1861-64 гг. английский ученый Грем, изучая диффузию растворов, заметил, что некоторые вещества в растворах диффундируют очень медленно. Растворы таких веществ, как крахмал, агар, декстрин по физическому состоянию напоминают клей (kolla греч. клей); поэтому Грем предложил все подобные вещества называть коллоидами, а науку, их изучающую, – коллоидной химией.
Природные объекты и искусственные материалы, как правило, представляют собой дисперсные системы. Воздух, насыщенный мельчайшими капельками воды (туман), почва, водоэмульсионные краски, зубная паста, кремы, цемент, сплавы металлов и тысячи других природных и созданных человеком объектов и материалов представляют собой дисперсные системы, в которых поверхность раздела фаз проявляет специфические свойства.
Дисперсной системой называется совокупность раздробленных частиц вместе со средой, в которой они находятся.
Дисперсность [лат. dispersus рассеянный, рассыпанный ] предполагает наличие поверхности, отделяющей одно вещество от другого, при этом одно вещество раздроблено до небольших частиц в сплошной среде другого. Чем меньше размер частиц, тем больше поверхность, разделяющая вещества, и тем в большей степени свойства дисперсной системы определяются свойствами поверхности раздела фаз.
Рассмотрим свойства, практическое применение и различные виды дисперсных систем.
ТЕМА 1
КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ
Вещество, структурными частями которого являются микрочастицы (атомы, молекулы, ионы), называется гомогенной (однородной) системой. Например, водный раствор соли – жидкая гомогенная система, состоящая только из микрочастиц (ионов и молекул воды).
Признаком гетерогенности системы служит наличие поверхности раздела фаз. Под фазой подразумевается гомогенная часть системы с одинаковыми физическими и химическими свойствами и отделенная от других частей поверхностью раздела. Гетерогенная (неоднородная) система состоит из двух или большего числа фаз. Например, вода в равновесии с паром и льдом – трехфазная гетерогенная система. Лед, жидкость и пар обладают одинаковыми химическими свойствами, но различаются физическими свойствами, например плотностью.
На рис. 1 представлены гомогенные и гетерогенные системы, различающиеся числом фаз j. Водный раствор соли будет представлять собой гомогенную однофазную систему (j = 1). Водный раствор соли в равновесии с паром и льдом – гетерогенная трехфазная система (j = 3). Система, включающая кристаллы соли, раствор соли, кристаллы льда и пары воды, представляет собой равновесную четырехфазную систему (j = 4).
В дальнейшем мы будем рассматривать такие гетерогенные системы, в которых раздробленность одной фазы в среде другой играет существенную роль.
В дисперсной системе раздробленные частицы представляют дисперсную фазу, которая распределена в однородной дисперсионной среде – в газе, жидкости или твердом теле.
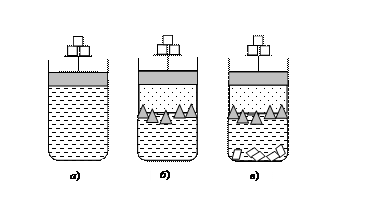
Рис. 1. Виды систем: (а) гомогенная система – водный раствор соли; (б) гетерогенная трехфазная система – пары воды, лед, водный раствор соли; (в) гетерогенная четырехфазная система – пары воды, лед, водный раствор соли, кристаллы соли
Частицы дисперсной фазы могут иметь форму шариков пленок, нитей, кубиков или, что чаще всего встречается, частиц неправильной формы (рис. 2).
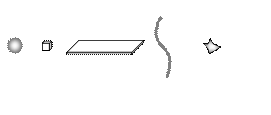
Рис. 2. Возможные формы частиц дисперсной фазы в виде сферы, куба, пленки, нити или частицы неправильной формы
Количественной характеристикой дисперсной системы служит величина удельной поверхности s уд. – площадь поверхности раздела фаз, приходящаяся на единицу объема или единицу массы дисперсной фазы.
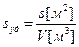 или
или 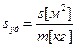 ,
,
где s – площадь, V –объем и m – масса дисперсной фазы.
Удельную поверхность дисперсной фазы несложно вычислить, если частицы одинаковые по размеру и форме. Тогда в зависимости от геометрической конфигурации (внешнему очертанию, форме) удельную поверхность частиц дисперсной фазы вычисляют по уравнению:
куб 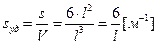 ,
,
сфера s уд. = s / V = 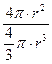 = 3/ r или
= 3/ r или 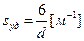 ,
,
пленка 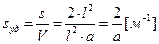 ,
,
нить 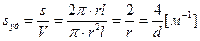 ,
,
где l – длина ребра куба, пленки; а – толщина пленки; r – радиус и d – диаметр сферы или поперечного сечения нити. Для вычисления площади поверхности, приходящейся на единицу массы, используют плотность вещества дисперсной фазы r = m / V. Например, для куба
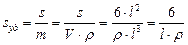 [м2/кг].
[м2/кг].
В случае частиц неопределенной формы, например частиц мелкой пыли, их можно условно рассматривать сферическими или кубическими телами.
Другой характеристикой дисперсной системы служит дисперсность D, которая оценивается величиной, обратной наименьшему размеру частиц, достигнутому при дроблении дисперсной фазы. Так, для пленки наименьшим размером является её толщина а:
D = 1/ а,
для куба – ребро l, для нити и сферы – диаметр d.
 2015-07-03
2015-07-03 699
699








