Известно, что видовой предел продолжительности жизни животных и человека примерно на 30-40% превышает среднюю длительность жизни. Это связано с воздействием на организм различных неблагоприятных факторов, которые приводят к изменению экспрессии и структуры генов, что сопровождается нарушением синтеза белка и снижением функций организма (рис. 1) [1, 22, 35, 39].
Видовой предел жизни человека - 110-120 лет

Рис. 1. Видовая продолжительность жизни человека и его биологический резерв.
Современная медико-демографическая ситуация в России характеризуется высокой преждевременной смертностью, уменьшением рождаемости, снижением средней продолжительности жизни, что в сочетании с ростом числа лиц пожилого и старческого возраста ведет к депопуляции населения и дефициту трудового потенциала [1, 12, 90].
В последнее десятилетие достижения в теоретической и прикладной геронтологии позволили осуществлять целенаправленную регуляцию возрастных изменений. Исходя из этого, одной из приоритетных задач современной геронтологии является профилактика ускоренного старения и возрастной патологии, направленная на увеличение средней продолжительности жизни, сохранение активного долголетия и достижение видового предела жизни человека [35, 73, 77, 90].
Применение достижений фундаментальной науки в медицине привело к пониманию того, что прогресс клинической медицины во многом зависит от медицины молекулярной, т.е. исследований, проводимых на уровне генов и биологически активных молекул. Молекулярная медицина также широко использует достижения генетики, молекулярной и клеточной биологии для конструирования новых лекарственных средств и технологий [1, 24, 73].
Одним из актуальных направлений молекулярной медицины является изучение генетических механизмов старения. В настоящее время установлено, что существуют гены, которые регулируют механизмы индивидуального развития и возникновения многих заболеваний [7, 8, 99].
При возрастном снижении процессов пролиферации и дифференцировки клеток существует возможность осуществлять коррекцию этих нарушений путем воздействия на экспрессию генов [20, 72, 73, 89]. Изучение генетических механизмов старения и развития возрастной патологии составляет основу регуляторной терапии – использования модуляторов транскрипции, сдерживающих и восстанавливающих наступающие с возрастом генетические изменения. Для этого необходимо знание генома, возникающих нарушений и использование веществ селективного воздействия на экспрессию генов [29, 36, 89]. Создание эффективных биорегуляторов, способствующих достижению видового предела продолжительности жизни и сохранению основных физиологических функций, является одной из наиболее актуальных проблем современной биогеронтологии. В исследованиях, посвященных данной проблеме, значительное внимание уделяется роли пептидов в предотвращении ускоренного старения [35, 82, 89].
Пептидная регуляция гомеостаза занимает важное место в сложной цепи физиологических процессов, приводящих к старению клеток, тканей, органов и организма в целом. Морфо-функциональным эквивалентом старения является инволюция органов и тканей и прежде всего тех, которые относятся к основным регуляторным системам – нервной, эндокринной и иммунной [16, 25, 37]. Имеются данные, свидетельствующие о возрастной гипоплазии, а в ряде случаев и об атрофии шишковидной железы (эпифиза), тимуса, нейронов коры головного мозга и подкорковых структур, сетчатки, сосудистой стенки, половых органов [10, 27, 37, 66].
В начале 1970-х гг. мы изучали механизм иммунодепрессии в эксперименте и клинике. Было установлено, что по мере старения происходит инволюция центрального органа иммунной системы - тимуса (рис. 2, 3) и нейроэндокринной системы – эпифиза [11, 21, 35]. Также было выявлено достоверное снижение синтеза белка в клетках различных тканей организма (рис. 4) [22, 35].
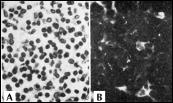
| Субкапсулярная зона коры (ребенок 2 года) А - окраска гематоксилином и эозином; В - свечение полипептидов тимуса в телах и отростках, образующих ячейки Кларка, а также в виде гранул на мембранах тимоцитов внутри ячеек. |
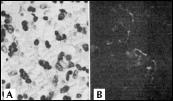
| Субкапсулярная зона коры (мужчина 46 лет) А - окраска гематоксилином и эозином; В - свечение полипептидов тимуса в телах и отростках эпителиальных клеток, образующих группы по 2-5 клеток. |
Рис. 2. Возрастная инволюция тимуса (непрямой иммунофлюоресцентный метод с антителами к полипептидам тимуса, х600).
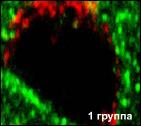
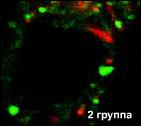
|
Иммунофлюоресцентная лазерная конфокальная микроскопия, х400 (красное свечение - Rodamin G, зеленое свечение - FITC). | |||||||||||||
|
Рис. 3. Синтез транскрипционных протеинов (PAX 1) в тимусных эпителиальных клетках человека (исследование выполнено совместно с Биомедицинским научно-исследовательским центром принца Филиппа, Валенсия, Испания).
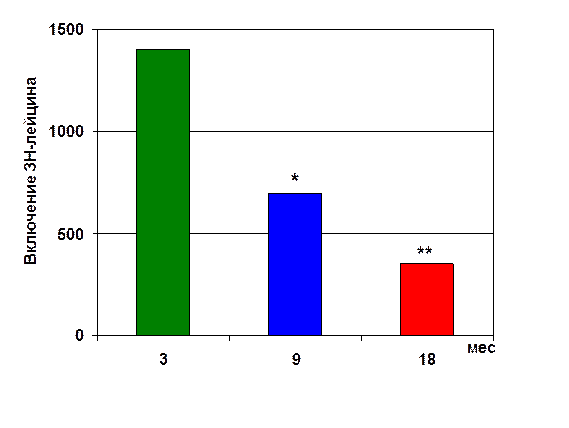
*- р<0.05 по сравнению с показателем у крыс 3 мес;
**- p<0.05 по сравнению с показателем у крыс 9 мес.
Рис. 4. Синтез белка в гепатоцитах крыс разного возраста.
Для восстановления функций тимуса, эпифиза, костного мозга и других органов нами был разработан специальный метод выделения и фракционирования низкомолекулярных пептидов из экстрактов этих органов [18, 43, 69, 106, 109].
На уровне целого организма у различных животных было продемонстрировано значительное разнообразие биологической активности коротких пептидов и особенно пептидного препарата тимуса (лекарственный препарат «тималин») и препарата эпифиза (лекарственный препарат «эпиталамин») [5, 6, 17, 21, 22, 35, 65, 82, 92]. Эти пептидные препараты в многочисленных экспериментах способствовали достоверному увеличению средней продолжительности жизни животных до 25-30% по сравнению с контролем [2, 3, 4, 35, 52, 56, 63, 64]. В большинстве экспериментов отмечено также некоторое увеличение максимальной продолжительности жизни. Наиболее значимый эффект увеличения максимальной продолжительности жизни был отмечен у мышей CBA при введении им пептида Ala-Glu-Asp-Gly и составил 42,3% [55]. Особенно следует отметить отчетливую корреляцию увеличения средней продолжительности жизни и основного показателя клеточного иммунитета – реакции бласттрансформации лимфоцитов с фитогемагглютинином (РБТЛ с ФГА), характеризующего функцию Т-лимфоцитов, при введении препаратов тимуса и эпифиза животным (рис. 5) [22, 56].
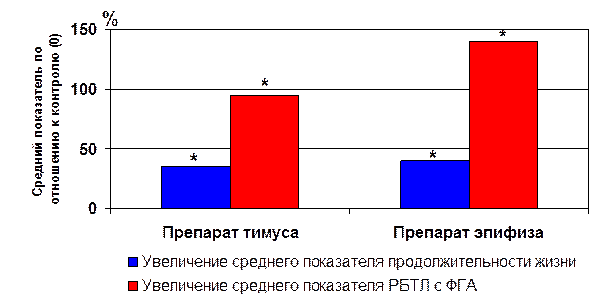
* - p<0.01 по сравнению с контролем (0)
Рис. 5. Влияние пептидных препаратов на среднюю продолжительность жизни и РБТЛ с ФГА у мышей.
Значительное увеличение средней продолжительности жизни животных безусловно было связано с тем, что низкомолекулярные пептиды, выделенные из эпифиза и тимуса, обладали достоверной противоопухолевой активностью, что выражалось в резком снижении в 1,4-7 раз частоты возникновения как спонтанных, так и индуцированных облучением или канцерогенами злокачественных опухолей у животных (рис.6) [35, 49, 56, 57, 60, 62, 63, 70]. Следует подчеркнуть, что этот беспрецедентный уровень уменьшения количества опухолей был отмечен в подавляющем большинстве экспериментов (более 30). Результаты этих исследований, учитывая общий механизм канцерогенеза у всех млекопитающих, имеют огромное практическое значение для профилактики опухолей у людей [35, 57, 91].
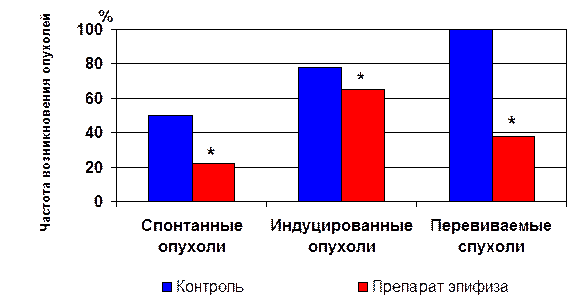
* - p<0.05 по сравнению с контролем
Рис. 6. Влияние пептидного препарата эпифиза на частоту возникновения опухолей у животных.
В специальных экспериментах было установлено, что короткие пептиды, выделенные из различных органов и тканей, а также их синтезированные аналоги (ди-, три-, тетрапептиды) обладают выраженной ткане-специфической активностью как в культуре клеток, так и в экспериментальных моделях у молодых и старых животных (рис. 7) [22, 36, 82].
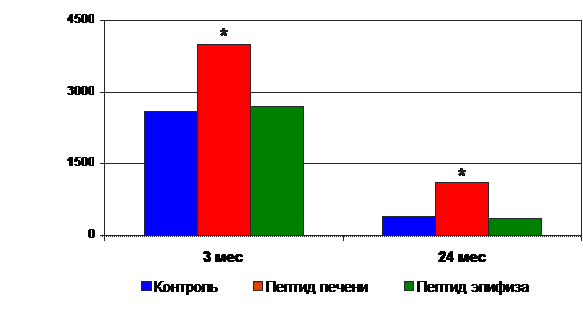
Воздействие пептидов приводило к тканеспецифической стимуляции синтеза белка в клетках тех органов, из которых эти пептиды были выделены. Эффект усиления синтеза белка при введении пептидов выявлен у молодых и старых животных (рис. 8).
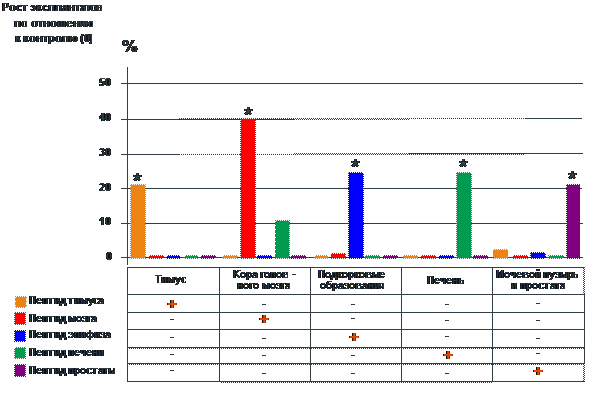
* - p<0.05 по сравнению с контролем (0)
Рис. 7. Пептидная тканеспецифическая регуляция роста эксплантатов тканей в органотипических культурах клеток.
|
* - p<0.05 по сравнению с контролем
Рис. 8. Влияние пептидов на синтез белка в гепатоцитах крыс разного возраста.
Особенно значимым явился факт восстановления репродуктивной системы у старых самок крыс после введения пептидного препарата эпифиза [6, 69]. Так, фаза эструса у животных, аналогичная менопаузе у женщин, от исходного состояния 95% уменьшилась после введения препарата до 52%, а остальные фазы цикла, характерные для нормы, возросли от исходных 5% до 48%. Необходимо подчеркнуть, что в другом эксперименте ни у одной старой крысы беременность после спаривания с молодыми самцами не наступала. После введения препарата эпифиза при повторном спаривании у 4 крыс из 16 наступила беременность, и у них родились по 5-9 здоровых крысят.
Таким образом, были установлены главные преимущества низкомолекулярных пептидов по сравнению с высокомолекулярными белковыми регуляторами: они обладают высокой биологической активностью, проявляют тканеспецифичность, у них отсутствуют видоспецифичность и иммуногенность. Эти характеристики сближают регуляторные пептиды с пептидными гормонами [17, 21, 79, 102].
В течение многих лет проводилось подробное изучение молекулярных масс, химических свойств, аминокислотного состава и последовательности аминокислот низкомолекулярных пептидов из тимуса, эпифиза и других органов [21, 22, 106, 107, 108, 109]. Полученная информация была использована для осуществления химического синтеза некоторых коротких пептидов. Сравнение показало, что биологическая активность природных и синтетических препаратов в основном идентична. Так, например, дипептид тимуса GluTrp стимулировал иммунитет, снижал темп старения и подавлял возникновение спонтанных опухолей у животных [17, 58, 59, 108]. Биологическая активность природных и синтетических пептидов была сходной при стандартном тестировании в культуре тканей и у животных [21, 35, 36, 53, 71, 86, 101, 108]. Эти результаты указывали на перспективность применения пептидов в качестве геропротекторных препаратов [2, 3, 4, 83]. Учитывая актуальность поиска новых лекарственных средств – геропротекторов, были проведены доклинические исследования пептидных препаратов на различных уровнях.
На уровне клеточных структур было обнаружено, что короткие пептиды активируют гетерохроматин в клеточных ядрах людей старческого возраста и способствуют «высвобождению» генов, репрессированных в результате гетерохроматинизации эухроматиновых районов хромосом, которая происходит при старении (табл. 1) [88, 104].
Таблица 1
Влияние пептидов на хроматин в лимфоцитах лиц старческого возраста
| Пептиды | Ассоциирующие акроцентрические хромосомы (на клетку) | Дегетеро-хроматинизация факультативного гетерохроматина (на клетку) | Общий гетеро-хроматин | Структурный гетерохроматин 1 хромосомы |
| Контроль (20-40 лет) | 1.33±0.06 | 7.7±0.4 | стабильное состояние | стабильное состояние |
| Контроль (75-88 лет) | 1.17±0.05* | 5.9±0.2* | гетерохрома-тинизация | гетерохрома-тинизация |
| Пептид Lys-Glu | 2.39±0.11** | 9.9±0.6** | дегетерохро-матинизация | гетерохрома-тинизация |
| Пептид Ala-Glu-Asp-Gly | 2.32±0.12** | 8.4±0.5** | дегетерохро-матинизация | дегетерохро-матинизация |
* - p<0.05 по сравнению с контролем (20-40 лет)
** - p<0.001 по сравнению с контролем (75-88 лет)
Структурная конденсация хроматина находится в тесной корреляции с функциональной гетерогенностью. Установлено, что при старении усиливается гетерохроматинизация, которая коррелирует с инактивацией ранее активных генов [104]. Плотно конденсированные гетерохроматиновые районы хромосом генетически инактивированы, поздно реплицируются. Деконденсированные (эухроматиновые) районы хромосом активно функционируют. Известно, что необходимым условием для транскрипционной активности генов является активный хроматин [103]. Как уже упоминалось выше, в клеточном ядре существует две разновидности хроматина: светлый эухроматин и плотный гетерохроматин, расположенный рядом с ядерной мембраной. Транскрипция генов происходит в светлой фазе – в эухроматине. При старении объём гетерохроматина в ядре увеличивается в среднем от 63% до 80%. Регуляторные пептиды увеличивают содержание эухроматина в ядре. Это означает, что большее число генов оказывается доступным для факторов транскрипции, а транскрипция происходит более интенсивно, и синтез белка увеличивается. Иными словами, чем выше содержание эухроматина в ядре, тем интенсивнее синтез белка в клетке [88, 103, 104]. Результаты этого эксперимента позволили сделать крайне важный вывод о том, что гетерохроматинизация хроматина является обратимым процессом, а это подтверждает возможность восстановления синтеза белка и следовательно функций организма [36, 89, 104].
Важнейшим экспериментальным фактом явилось обнаружение способности пептидов индуцировать дифференцировку полипотентных клеток (рис. 9) [36, 38]. Так, добавление пептидов сетчатки к полипотентным клеткам эктодермы ранней гаструлы лягушки Xenopus laevis привело к возникновению клеток сетчатки и пигментного эпителия. Этот выдающийся результат в значительной степени объясняет положительный клинический эффект после применения препарата сетчатки у людей при дегенеративных заболеваниях сетчатки [27, 35, 82] и у животных с генетически детерминированным пигментным ретинитом [35, 94].
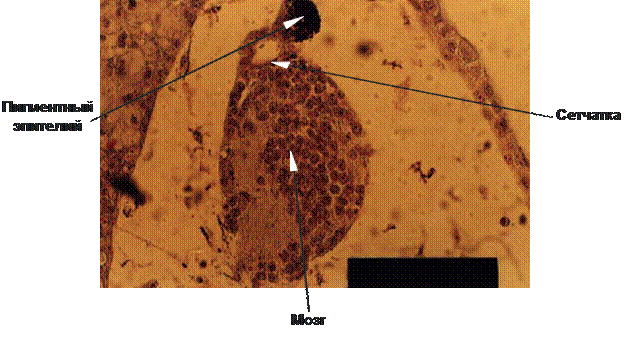
Рис. 9. Индукционное влияние пептидов сетчатки на полипотентные клетки эктодермы ранней гаструлы Xenopus laevis.
Добавление других коротких пептидов к полипотентным клеткам эктодермы в этой же экспериментальной модели приводило к возникновению различных тканей. Эти эксперименты показали, что пептиды способны индуцировать дифференцировку клеток в зависимости от структуры добавляемого вещества. Анализ результатов этих исследований дает основание сделать принципиальный вывод о возможности целенаправленной индукции дифференцировки полипотентных клеток и использования биологического клеточного резерва различных органов и тканей организма, что составляет основу увеличения продолжительности жизни до видового предела.
Известно, что число хромосомных аберраций используется как маркер повреждений ДНК в стареющем организме. Соматические мутации могут возникать из-за накопления устойчивых аберраций и лежат в основе возрастной патологии, включая злокачественные опухоли [111]. Достоверная антимутагенная и репаративная активность пептидов тимуса и эпифиза была подтверждена снижением числа хромосомных аберраций в клетках костного мозга и эпителия роговицы животных с ускоренным старением [36, 61, 89, 100].
На уровне регуляции активности генов установлено, что пептиды Lys-Glu и Ala-Glu-Asp-Gly при введении в организм трансгенных мышей подавляют экспрессию гена HER-2/neu (рак молочной железы человека в 2 – 3,6 раза по сравнению с контролем). Это подавление экспрессии гена сопровождается достоверным уменьшением диаметра опухоли (рис. 10) [35, 36, 62, 89].
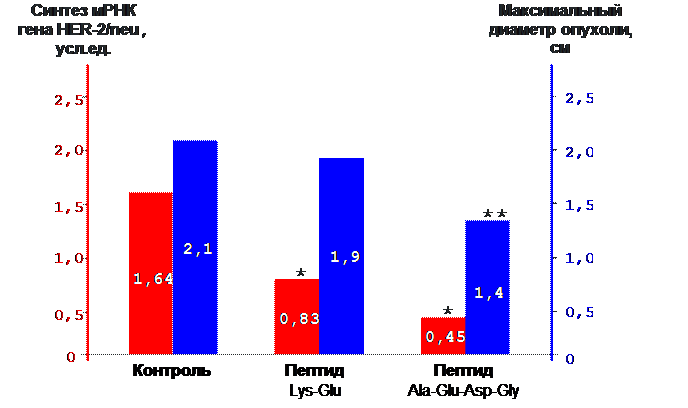
*- р<0.001 по сравнению с показателем в контроле
**- р<0.05 по сравнению с показателем в контроле
Рис. 10. Влияние пептидов на развитие аденокарцином молочной железы и экспрессию онкогена HER-2/neu у трансгенных мышей (исследование выполнено совместно с Национальным центром старения, Анкона, Италия).
Обнаружено, что добавление пептида Ala-Glu-Asp-Gly в культуру легочных фибробластов человека и инкубирование их при 30º С в течение 30 мин индуцирует экспрессию гена теломеразы, активность теломеразы и способствует удлинению теломер в 2,4 раза. Активация экспрессии гена сопровождается увеличением числа делений клеток на 42,5%, что демонстрирует преодоление предела клеточного деления Хейфлика (рис. 11) [36, 89]. Этот важнейший результат полностью коррелирует с ранее указанным максимальным увеличением продолжительности жизни у животных (42,3%) после введения этого пептида [22, 55].
С использованием ДНК-микрочиповой технологии выполнено исследование влияния пептидов Lys-Glu, Glu-Trp, Ala-Glu-Asp-Gly, Ala-Glu-Asp-Pro на экспрессию 15247 генов сердца и головного мозга мышей [51, 89]. В экспериментах использовали клоны, входящие в библиотеку кДНК Национального института старения США. В этих экспериментах были получены уникальные данные по изменению экспрессии различных генов под влиянием пептидов (рис. 12). Важным выводом явилось то, что каждый пептид специфически регулирует конкретные гены. Результаты эксперимента указывают на существующий механизм пептидной регуляции генетической активности. В эксперименте было также установлено что дипептид Lys-Glu, обладающий иммуномодулирующей активностью, регулирует экспрессию гена интерлейкина-2 в лимфоцитах крови [36, 89].
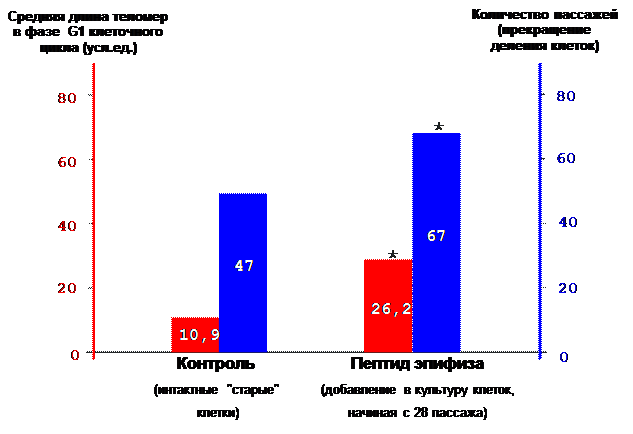
Увеличение числа делений клеток в опыте по сравнению с контролем на 42.5%
* - р<0.05 по сравнению с контролем
Рис. 11. Преодоление лимита деления соматических клеток человека при добавлении пептида Ala-Glu-Asp-Gly в культуру легочных фибробластов.
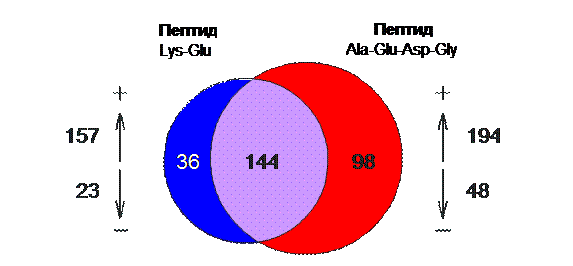
Исследовано 15247 генов
(ДНК-микрочиповая технология)
(максимальное повышение в 6,61 раза, максимальное снижение в 2,71 раза)
Рис. 12. Влияние пептидов на экспрессию генов в сердце мыши (исследование выполнено совместно с Национальным институтом старения, Балтимор, США).
На молекулярном уровне существовал очевидный разрыв между многочисленными доказательствами специфических эффектов, вызванных регуляторными пептидами в активации транскрипции генов [36, 87, 89, 110], и ограниченными схемами процесса, который лежит в основе селективного связывания факторов транскрипции со специфическими сайтами ДНК. При этом неспецифическое связывание белков с двойной спиралью ДНК было доказано физико-химическими методами [45, 47]. Для активации транскрипции гена в клетках высших организмов, как правило, требуются десятки макромолекулярных активаторов и факторов транскрипции.
Нами была предложена молекулярная модель взаимодействия регуляторных пептидов и двойной спирали ДНК на промоторном участке гена (рис. 13, 14, 15, 16) [36, 45, 46, 89, 95].
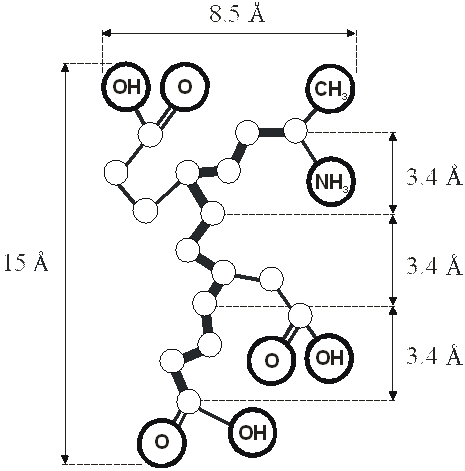
Рис. 13. Развернутая конформация пептида Ala-Glu-Asp-Gly (проекция на плоскость). Представлены концевые и боковые функциональные группы, способные к комплементарным взаимодействиям с ДНК.
—NH3, —OH - протон-донорные группы;
=O - протон-акцепторные группы;
—CH3 - гидрофобная (метильная) группа.
Утолщенная линия обозначает основную пептидную цепь.
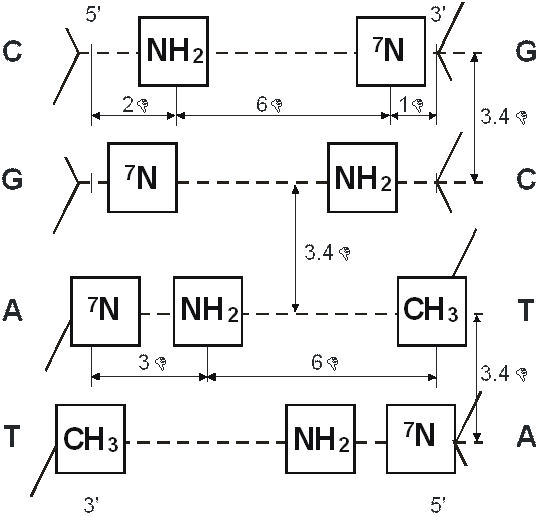
Рис. 14. Метрическое расположение функциональных групп на поверхности большой канавки при встраивании каждой нуклеотидной пары в двойную спираль ДНК.
Штриховая линия представляет перпендикулярную плоскость, в которой расположены ароматические структуры нуклеиновых оснований.
—NH2 - протон-донорные группы;
=7N - протон-акцепторные группы;
—CH3 - гидрофобная (метильная) группа.
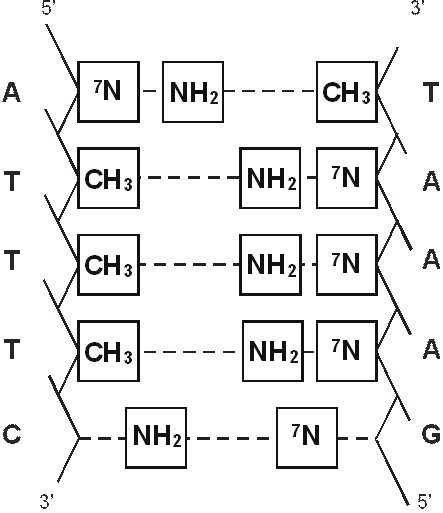
Рис. 15. Последовательность нуклеотидных пар в двойной спирали ДНК, функциональные группы которой комплементарны функциональным группам пептида Ala-Glu-Asp-Gly.
Эта последовательность нуклеотидных пар многократно повторяется на промоторном участке гена теломеразы.
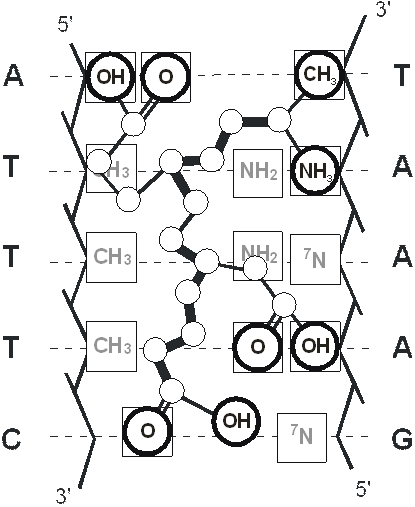
Рис. 16. Модель комплементарного взаимодействия пептида Ala-Glu-Asp-Gly с двойной спиралью ДНК (комплекс ДНК-пептид на промоторном участке гена теломеразы).
Геометрическая и химическая комплементарность аминокислотной последовательности пептида и последовательности нуклеотидных пар ДНК были положены в основу молекулярной модели. Регуляторный пептид распознаёт специфический сайт в двойной спирали ДНК, если его собственная аминокислотная последовательность комплементарна на достаточном протяжении последовательности нуклеотидов ДНК; другими словами – их взаимодействие специфично из-за совпадения последовательностей.
Каждая последовательность нуклеотидных пар в двойной спирали ДНК образует уникальный узор функциональных групп на поверхности большой канавки двойной спирали ДНК. Пептид в развёрнутой β-конформации может комплементарно расположиться в большой канавке ДНК вдоль оси двойной спирали. Литературные данные о молекулярной геометрии двойной спирали ДНК и пептидной β-нити были использованы для того, чтобы найти последовательность нуклеотидных пар для специфического связывания ДНК и пептида Ala-Glu-Asp-Gly. Скрининг показал, что этот тетрапептид может быть размещён в большой канавке ДНК с последовательностью нуклеотидов на ведущей цепи ATTTG (или ATTTC) в соответствии с комплементарностью расположения их функциональных групп [45, 47].
Для экспериментальной проверки молекулярной модели были использованы синтетические препараты: ДНК [поли(dA-dT):поли(dA-dT)] (двойная спираль) и пептидAla-Glu-Asp-Gly. С помощью гельхроматографии было доказано, что пептид Ala-Glu-Asp-Gly образует устойчивый межмолекулярный комплекс с двойной спиралью ДНК (рис. 17) [45, 89, 95].
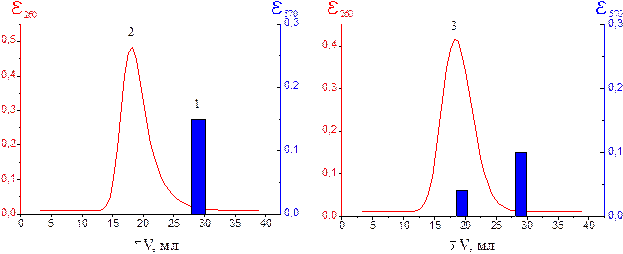
1 - индивидуальный пептид Ala-Glu-Asp-Gly
2 - свободная двойная спираль ДНК [поли(dA-dT):поли(dA-dT)]
3 - смесь пептида и ДНК
Рис. 17. Гельхроматография пептида и ДНК на сефадексе G-25 в физиологическом растворе при комнатной температуре.
Комплементарное связывание пептида с последовательностью нуклеотидов на ведущей цепи ТАТАТА двойной спирали может быть осуществлено посредством шести водородных и одной гидрофобной связей между функциональными группами обоих участников.
В нормальных физиологических условиях ДНК существует в форме двойной спирали, две полимерных цепи которой удерживаются вместе водородными связями между парами оснований на каждой цепи. Большинство биологических процессов, включающих ДНК (транскрипция, репликация), требует, чтобы двойная спираль разделилась на отдельные цепи. В частности, известно, что локальное разделение цепей двойной спирали предшествует транскрипции генов РНК полимеразой. Для того, чтобы началась транскрипция (синтез матричной РНК), двойная спираль ДНК должна быть освобождена от гистонов, а в том месте, где начинается синтез матричной РНК, цепи двойной спирали должны быть разделены(рис. 18).

Рис. 18. Схема локального разделения цепей [поли(dA-dT):поли(dA-dT)] в результате связывания пептида Ala-Glu-Asp-Gly в большой канавке двойной спирали ДНК.
C использованием спектрофотометрии в ультрафиолетовой области растворов синтетической двойной спирали ДНК и пептида Ala‑Glu‑Asp‑Gly обнаружен концентрационно зависимый гиперхромный эффект (увеличение оптической плотности раствора при длине волны 260 нм) в смеси пептида и двуспиральной ДНК. Гиперхромный эффект свидетельствует о частичном разрушении водородных связей между нуклеотидными парами двойной спирали и о локальном разделении цепей двойной спирали (аллостерическое конформационное изменение) [44, 45].
В специальном эксперименте установлено, что разделение цепей (плавление) свободной синтетической ДНК происходит при температуре +69,50 С. В системе ДНК с пептидом плавление спирали произошло при +280 С и характеризовалось снижением показателей энтропии и энтальпии процесса примерно в 2 раза [44]. Этот важный факт указывает на практическую возможность термодинамически облегченного пути разделения цепей ДНК при температурном режиме, характерном для биохимических реакций большинства живых организмов. Это свидетельствует также о том, что разделение цепей ДНК при физиологической температуре не является денатурацией и характерно для инициации процесса синтеза белка. Эксперименты in vitro показывают, что короткий пептид определённой структуры и аминокислотной последовательности можетучаствовать в активации транскрипциигенов на этапе разделения цепей двойной спирали ДНК. Биохимический аспект этого факта состоит в сходстве структуры и аминокислотной последовательности регуляторного пептида и специфического участка пептидной цепи макромолекулярного фактора транскрипции.
Следует сделать выводы, что изучение биологической активности пептидов на различных структурных уровнях и исследование физико-химических процессов их взаимодействия показало несомненную высокую физиологическую активность пептидных регуляторов и перспективность их дальнейшего использования. Основным выводом явилось то, что пептиды обладают способностью регулировать экспрессию генов. В доклинических исследованиях установлена высокая биологическая активность и безопасность синтезированных пептидов [17, 19, 21, 35, 82]. Так, введение пептидов Lys-Glu, Ala-Glu-Asp-Gly животным способствовало уменьшению частоты развития опухолей и увеличению средней продолжительности жизни [9, 33, 34, 60, 61, 62]. Пептид Ala-Glu-Asp-Pro стимулировал регенерацию нерва [35, 36, 93], пептид Lys-Glu-Asp-Trp снижал уровень глюкозы в крови у животных с экспериментальным сахарным диабетом [32], пептид Ala-Glu-Asp увеличивал плотность костной ткани [26], пептид Ala-Glu-Asp-Leu способствовал восстановлению функций клеток бронхиального эпителия [97], пептид Ala-Glu-Asp-Arg восстанавливал функциональную активность клеток миокарда [98].
В настоящее время продолжается исследование пептидных препаратов, выделенных из хрящей, семенников, печени, сосудов, мочевого пузыря, щитовидной железы, а также синтезированных пептидов, регулирующих функцию мозга, сетчатки, иммунной системы, пролиферацию и дифференцировку полипотентных клеток. Эти физиологически активные вещества обладают, как правило, значительной тканеспецифической активностью и безусловно перспективны для создания на их основе новых лекарственных препаратов для биорегулирующей терапии [30, 31, 35].
Применение пептидных биорегуляторов у обезьян. Учитывая значительную достоверную биологическую активность пептидов, следующим целесообразным этапом явилось изучение пептидных регуляторов у обезьян (макак резусов, Macaca mulatta) [11, 75]. Важным достижением оказался результат полного восстановления уровня секреции мелатонина до нормы молодых животных (6-8 лет) у старых обезьян (20-26 лет) после введения пептида эпифиза (рис. 19) [11, 85].
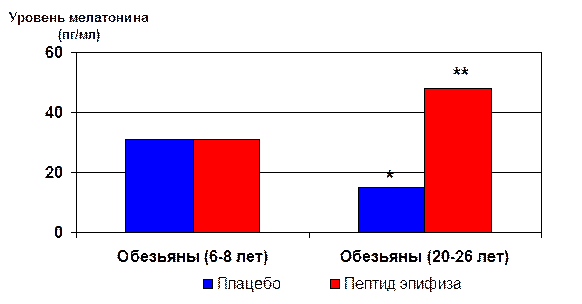
* - p<0.01 по сравнению с контрольной группой молодых животных (плацебо)
**- p<0.001 по сравнению с контрольной группой старых животных (плацебо)
Рис. 19. Влияние пептида эпифиза на продукцию мелатонина у обезьян различного возраста.
У этих же старых обезьян после введения пептида восстановился до нормы суточный ритм секреции основного гормона надпочечников – кортизола (рис. 20). Введение пептида или препарата эпифиза старым животным привело также к восстановлению нарушающейся при старении толерантности к глюкозе. Восстанавливающее действие пептидов эпифиза на функцию островкового аппарата поджелудочной железы и метаболизм глюкозы, по-видимому, связано с восстановлением как чувствительности бета-клеток к уровню глюкозы в крови, так и периферических тканей к инсулину [11, 75]. В связи с полной корреляцией механизмов старения у приматов и человека логично использование пептидов эпифиза для коррекции функции пинеальной железы, продуцирующей мелатонин, островкового аппарата поджелудочной железы и гипоталамо-гипофизарно-адреналовой системы у людей старших возрастных групп.
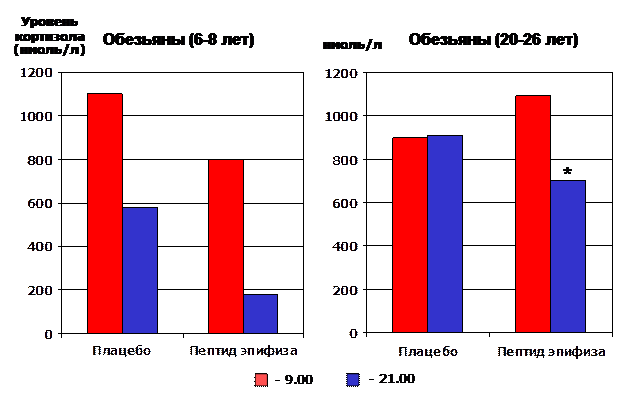
*- p<0.05 в сравнении с соответствующим показателем (21.00)
у животных контрольной группы (плацебо)
Рис. 20. Влияние пептида эпифиза на продукцию кортизола у обезьян различного возраста (в разное время суток).
Применение пептидных биорегуляторов у людей. Учитывая вышеизложенные данные, свидетельствующие о высокой геропротекторной активности как природных тканеспецифических, так и синтетических пептидных препаратов, особое внимание в последние годы было уделено изучению эффективности пептидных препаратов и пептидов у людей пожилого и старческого возраста [14, 22, 35, 41, 42, 48, 54, 96]. Так, ежегодное курсовое применение препаратов тимуса («тималин») и эпифиза («эпиталамин») привело к достоверному снижению смертности пациентов в течение наблюдаемого периода (6-12 лет) (табл. 2), что было связано с улучшением функций иммунной, эндокринной, сердечно-сосудистой систем, мозга, повышением плотности костной ткани (рис. 21, 22) [13, 14, 15, 82, 91]. Следует отметить, что применение препарата тимуса привело к снижению в 2 раза частоты острых респираторных заболеваний (рис. 23) [14, 91].
Таблица 2
Влияние пептидных препаратов на уровень смертности
пациентов пожилого и старческого возраста
| Группа пациентов | Показатель | Контроль (применение поливитаминов) | Применение препарата эпифиза | Применение комплекса пре-паратов тимуса и эпифиза |
| Пожилой возраст (60-74 лет) | Исходный средний возраст, лет | 69,3± 2,2 | 71,1± 1,4 | исследование не проводилось |
| Смертность в течение 8 лет, % | 13,6 | 8,5* | ||
| Смертность в течение 12 лет, % | 44,1 | 22,3* | ||
| Старческий возраст (75-89 лет) | Исходный средний возраст, лет | 80,2± 1,6 | 81,5± 2,1 | 82,1± 2,3 |
| Смертность в течение 6 лет, % | 81,8 | 45,8* | 33,3* |
* - p<0.05 по сравнению с показателем в контрольной группе
Особенно значимым явился факт восстановления уровня секреции мелатонина у пациентов после введения пептида или препарата эпифиза (рис. 24) [11, 13, 14].
Применение препарата эпифиза у пациентов приводило к значительному повышению антиоксидантной активности [35, 50], устойчивости организма к стрессорным воздействиям [17, 21], оказывало нормализующее действие на углеводный обмен [11, 35]. Гипогликемическое действие препарата эпифиза было обусловлено возрастанием секреции инсулина, которое сочеталось с повышением чувствительности периферических тканей к инсулину. Влияние пептидов эпифиза на уровень гликемии носило модулирующий характер и снижалось по мере достижения компенсации заболевания. После лечения этим препаратом больных инсулиннезависимым сахарным диабетом с гипертонической болезнью у них отмечалось снижение артериального давления и восстановление диастолической функции миокарда [35, 82]. Значительный лечебный эффект после применения препарата эпифиза был отмечен у больных женщин с климактерической миокардиодистрофией, что коррелировало с нормализацией у них показателей иммунной и эндокринной систем [82]. Эффективность препарата эпифиза обнаружена при лечении больных аспириновой астмой, у которых выявлено исходно низкое содержание мелатонина, а также у пациентов с астеническим состоянием [35, 82].
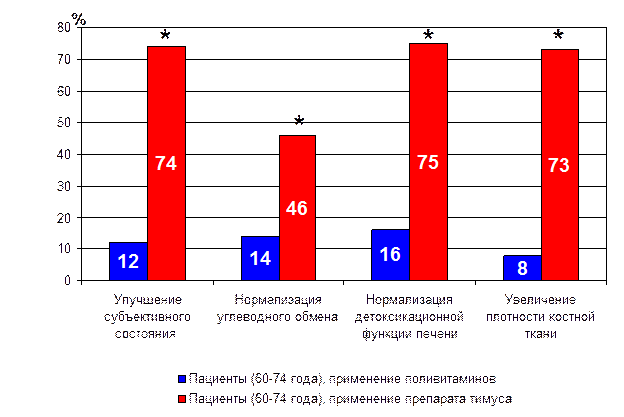
* - p<0.05 по сравнению с показателем в контрольной группе (применение поливитаминов)
Рис. 21. Влияние препарата тимуса на показатели метаболизма у пациентов пожилого возраста (60-74 года).
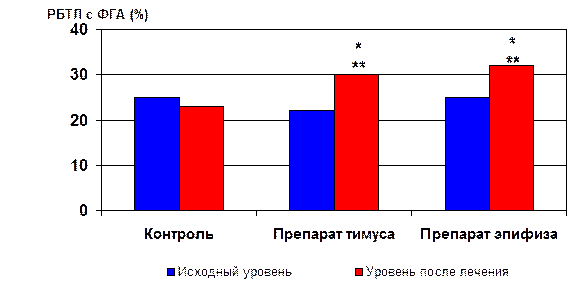
* - p<0.05 по сравнению с аналогичным показателем в контрольной группе
** - p<0.05 по сравнению с исходным уровнем в группе
Рис 22. Динамика РБТЛ с ФГА у пациентов пожилого возраста через 3 года после введения 6 курсов пептидных биорегуляторов.
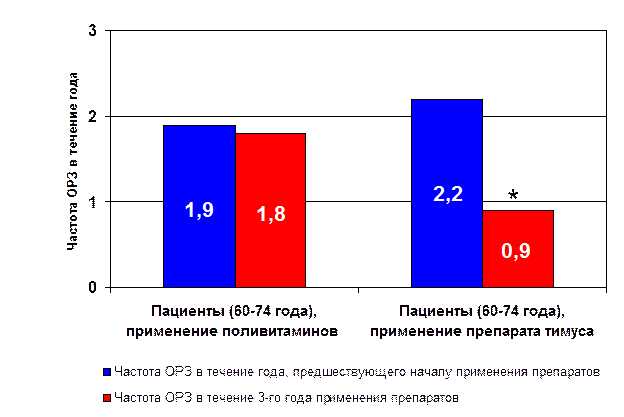 * - p<0.05 по сравнению с показателем до применения препаратов
* - p<0.05 по сравнению с показателем до применения препаратов
Рис. 23. Частота острых респираторных заболеваний у пациентов пожилого возраста при применении препарата тимуса.
|
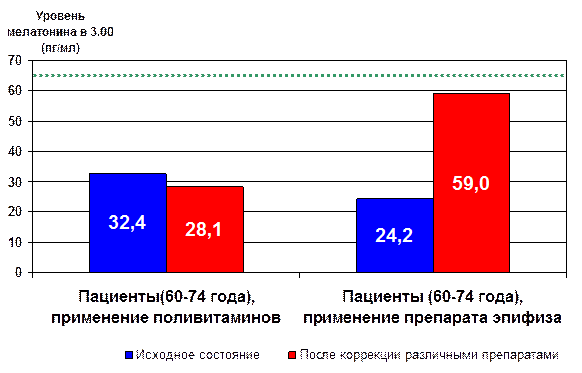
 - уровень мелатонина у здоровых людей (20-40 лет)
- уровень мелатонина у здоровых людей (20-40 лет)
* - p<0.05 по сравнению с исходным показателем
Рис. 24. Влияние препарата эпифиза на уровень мелатонина в крови пожилых людей.
Применение препарата тимуса было крайне эффективным у больных после тимэктомии по поводу опухолей тимуса. Через 6-18 мес. после операции у них развивалось тяжелое иммунодефицитное состояние, которое выражалось в резком увеличении частоты респираторных вирусных инфекций, возникновении повторных пневмоний, появлении фурункулеза, снижении способностей тканей к регенерации, появлении признаков преждевременного старения (ослабление тургора кожи, поседение волос, увеличение массы жировой ткани, нарушение функции эндокринной системы и т.д.). Этим пациентам вводили только препарат тимуса без других лекарственных препаратов. После курса лечения отмечено восстановление показателей клеточного иммунитета, исчезновение фурункулеза, усиление мышечного тонуса. Впоследствии отмечено значительное снижение частоты вирусных заболеваний и пневмоний. Повторные курсы препарата проводились через 6-8 мес. Эти больные получали пептиды тимуса как природного происхождения (лекарственный препарат «тималин»), так и синтетического (лекарственный препарат «тимоген») в течение 15-20 лет. Следует подчеркнуть, что применение пептидов тимуса у этих пациентов явилось жизненно важным методом лечения [21, 22, 35, 82]. Особенная ценность этого исследования заключалась в том, что обнаружена полная корреляция с позитивными результатами при введении пептидов тимуса животным после удаления у них тимуса [19, 22].
Применение пептидных препаратов тимуса (лекарственных препаратов «тималин», «тимоген», «вилон») оказалось эффективным при многих заболеваниях и состояниях, связанных со снижением клеточного иммунитета и фагоцитоза: при лучевой терапии и химиотерапии у онкологических больных, при острых и хронических инфекционно-воспалительных заболеваниях, использовании массивных доз антибиотиков, при угнетении процессов регенерации в посттравматическом и послеоперационном периоде в случаях различных осложнений, при облитерирующих заболеваниях артерий конечностей, при хронических заболеваниях печени, предстательной железы, в комплексном лечении некоторых форм туберкулеза, лепры [17, 21, 35, 82].
Значительным нейропротекторным действием обладает пептидный препарат «кортексин», выделенный из коры головного мозга. Этот препарат улучшает процессы памяти, стимулирует репаративные процессы в головном мозге, ускоряет восстановление его функций после стрессорных воздействий. Препарат эффективно применяется при черепно-мозговой травме, нарушениях мозгового кровообращения, вирусных и бактериальных нейроинфекциях, энцефалопатиях различного генеза, острых и хронических энцефалитах и энцефаломиелитах. Особенно высокая эффективность пептидного препарата мозга отмечена у лиц пожилого и старческого возраста [17, 21, 35, 82].
Яркой клинической эффективностью обладает пептидный препарат «ретиналамин», выделенный из сетчатки глаза животных. Этот уникальный препарат был создан нами впервые в медицинской практике и применен у больных при различных дегенеративных заболеваниях сетчатки, в том числе при диабетической ретинопатии, инволюционной дистрофии, пигментной дегенерации сетчатки и при другой патологии. Особенно важной явилась способность препарата восстанавливать электрическую активность сетчатки, что, как правило, коррелировало с улучшением функции зрения [17, 21, 35, 38, 82].
Отчетливый эффект у больных отмечен после применения пептидного препарата «простатилен» («сампрост»), выделенного из предстательной железы животных. Препарат оказался эффективным при хроническом простатите, аденоме, осложнениях после операций на предстательной железе, а также при различных возрастных нарушениях функции простаты [10, 17, 21, 35].
Многолетнее изучение и применение пептидных препаратов эпифиза, тимуса, мозга, сетчатки, простаты показало их высокую эффективность у пациентов различных возрастных групп, но особенная эффективность была отмечена у лиц старшего возраста (старше 60 лет). Безусловным достоинством этой группы пептидных биорегуляторов-геропротекторов является отсутствие каких-либо побочных реакций. Необходимо подчеркнуть, что в течение 26 лет препараты получили более 15 млн человек с различной патологией. Эффективность применения составляла в среднем 75-85%.
Представленные результаты клинических исследований безусловно открывают определенные перспективы для решения некоторых демографических проблем [1, 22, 35, 90, 96].
 2015-07-02
2015-07-02 708
708








