изменяется по направлению, то есть 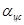 = const по модулю, но
= const по модулю, но 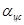
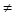 const по
const по
направлению 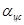 =
= 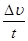 =
= 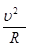 =
= 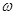 2 R =
2 R = 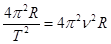
4(2)Электрический ток в жидкостях. Жидкости, как и твёрдые тела, могут быть диэлектриками (дистиллированная вода), П.П.(расплав селена), проводниками (расплав металлов, растворы электролитов). Электрический ток в расплавах металлов – направленное движение электронов. Электролит – водный раствор солей, кислот, оснований. Электролитическая
CuSO4 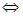 Cu+2 +SO4 -2 диссоциация – процесс распада молекул электролитов на ионы,
Cu+2 +SO4 -2 диссоциация – процесс распада молекул электролитов на ионы,
HCl 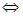 H+1 + Cl-1 которые, вне электрического поля движутся беспорядочно, но в
H+1 + Cl-1 которые, вне электрического поля движутся беспорядочно, но в
NaOH 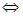 Na+1 + OH-1 электрическом поле “+” ионы движутся к катоду, а ” –“ ионы движутся к аноду. Рекомбинация – процесс объединения ионов в молекулы. Электролиз – процесс выделения вещества на электроде при прохождении тока через электролит. Применение электролиза. 1. Покрытие изделия слоем нержавеющего металла (никелирование, позолота, хромирование и т.д.).2.Получение копий с рельефной поверхности. 3. Очистка металлов от примесей. 4. Получение алюминия из расплава бокситов.5. При зарядки аккумуляторов.
Na+1 + OH-1 электрическом поле “+” ионы движутся к катоду, а ” –“ ионы движутся к аноду. Рекомбинация – процесс объединения ионов в молекулы. Электролиз – процесс выделения вещества на электроде при прохождении тока через электролит. Применение электролиза. 1. Покрытие изделия слоем нержавеющего металла (никелирование, позолота, хромирование и т.д.).2.Получение копий с рельефной поверхности. 3. Очистка металлов от примесей. 4. Получение алюминия из расплава бокситов.5. При зарядки аккумуляторов.
Закон электролиза – закон Фарадея. m = kq = kIt = 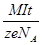 - масса вещества, выделившегося при электролизе прямо пропорциональна электрическому заряду, протекающему через электролит.
- масса вещества, выделившегося при электролизе прямо пропорциональна электрическому заряду, протекающему через электролит.
k 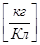 - электрохимический эквивалент равен массе вещества, выделяющемуся на электроде при прохождении через электролит заряда в один кулон, зависит от рода вещества, определяется по таблице. k =
- электрохимический эквивалент равен массе вещества, выделяющемуся на электроде при прохождении через электролит заряда в один кулон, зависит от рода вещества, определяется по таблице. k = 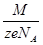 M
M 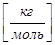 - молярная масса вещества, NA = 61023
- молярная масса вещества, NA = 61023 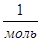 - число Авогадро z
- число Авогадро z 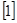 - валентность вещества, e = 1,6 10-19 Кл – заряд электрона., q
- валентность вещества, e = 1,6 10-19 Кл – заряд электрона., q 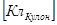 - заряд, протекающий через электролит, I
- заряд, протекающий через электролит, I 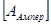 - сила тока, t
- сила тока, t 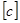 - время электролиза.
- время электролиза.
 2015-07-14
2015-07-14 1519
1519








