1.Знание строения и свойств комплексных соединений необходимо в методе анализа - комплексонометрии при определении ионов: Zn2+, Mg2+, Ca2+, Ba2+, Cd2+.
p Комплексонометрический метод основан на реакции комплексообразования катионов металлов с комплексонами.
Комплексонами являются, например,
А) этилендиаминтетрауксусная кислота (ЭДТУК) – четырехосновная кислота:
HOOCCH2 CH2COOH
\ /
N-CH2-CH2 – N
/ \
HOOCCH2 CH2COOH (H4Y –сокращенное название)
Б) трилон Б – двузамещенная натриевая соль этилендиаминтетрауксусной кислоты- Na2H2Y. Распространенное название этого комплексона – ЭДТА (этилендиаминтетраацетат). Максимальная дентатность его равна шести и при образовании комплексных соединений – комплексонатов возникает несколько хелатных циклов, поэтому комплексы обладают высокой устойчивостью. Ион металла М2+ (например, Са2+ и Мg2+) замещает в ЭДТА два атома водорода карбоксильных групп и связывается еще с атомами азота донорно-акцепторной связью:
O=C-O O-C=O
| \ / |
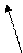
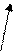 | M |
| M |
H2C CH2
\ /

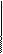 N N
N N
/ \
HOOCH2C CH2COOH
 H2 C CH2
H2 C CH2
Металл 3+ замыкает еще одно кольцо с СООН- группой.
2. Некоторые органические вещества могут использоваться как лиганды для связывания вредных ионов и выведения их из организма.
3. Комплексные соединения получаются во многих химических реакциях.
II.10. Кристаллогидраты солей можно рассматривать, как комплексные соединения. В водных растворах все ионы окружены молекулвми воды, то есть, гидратированы. Реализуя определенное координационное число, эти ионы существуют в виде комплексов, хотя часть молекул воды может быть во внешней сфере:
CuSO4∙5H2O - медный купорос - пятиводный кристаллогидрат сульфата меди (II).
Координационное число иона меди (Cu2+) = 4
Формула медного купороса в виде комплексного соединения:
[Cu(H2O)4]SO4∙H2O монокристаллогидрат пентааквамеди (II) cульфата
II.11. Двойные соли. KAl(SO4)2 - сульфат калия, алюминия.
Имеют ионную связь (между атомами металлов и кислорода) и ковалентную связь (между атомами неметаллов). В твердом состоянии эти соли можно отнести к комплексным соединениям в твердом состоянии. В растворах же такие соли полностью диссоциируют на ионы.
K-O O
\ //
S
/ \\
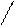 O O
O O
Al –O O à K+ + Al3+ + 2 SO42-
 \ //
\ //
S
/ \\
O O
 2015-07-14
2015-07-14 1713
1713
