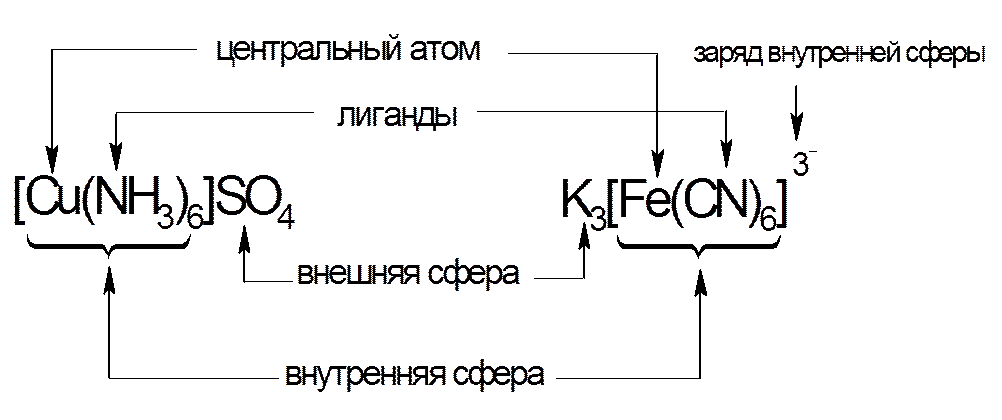
3. НОМЕНКЛАТУРА КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Название комплексного соединения состоит из двух слов, состоящих из названий аниона и катиона. Название читается справа налево, при этом анион называют в именительном падеже, а катион – в родительном.
Названии комплексного иона (или электронейтральной комплексной частицы) включают число лигандов и их название. Число лигандов указывают греческими числительными:
1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта, 8 – окта.
Названия наиболее распространённых лигандов: F– – фторо-; Cl– – хлоро-; Br– – бромо-; I– – йодо; OH– – гидроксо-; SO32– – сульфито-; NO2– – нитро-; CN– – циано-; NCS– – родано-, NH3–аммин-; en- – этилендиамин-, H2O – аква-.
Название комплексообразователя зависит от заряда иона в который он входит. В случае комплексного катиона или комплексной частицы без внешней сферы применяется русское название комплексообразователя, а в случае комплексного аниона – после названия лигандов добавляется корень латинского названия элемента-комплексообразователя и окончание «-ат».
Если в состав внутренней сферы комплекса входят в качестве лигандов молекулы и анионы, то в первую очередь называют анионы (с окончанием на «о»), а затем молекулы. Если для комплексообразователя возможно несколько степеней окисления, то ее указывают в круглых скобках римской цифрой.
Примеры названий комплексных соединений анионного типа:
Na[Al(OH)4] – тетрагидроксоалюминат натрия
K3[Fe(CN)6] – гексацианоферрат (III) калия
K4[Fe(CN)6] – гексацианоферрат (II) калия
K2[Pt(NH3)2Cl4] – тетрахлородиамминплатинат (II) калия
Примеры названий комплексных соединений катионного типа:
[Ag(NH3)2]Cl – хлорид диамминсеребра
[Pt(NH3)4Cl2]Cl2 –хлорид дихлоротетраамминплатины (IV)
[Cu(H2O)4]SO4 – сульфат тетрааквамеди (II)
Примеры названий электронейтральных комплексов:
[Cr(H2O)3F3] – трифторотриаквахром
[Co(NH3)3(NO2)2Cl] – хлородинитротриамминкобальт
[Pt(NH3)4Br2] – дибромотетраамминплатина
4. ДИССОЦИАЦИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ
Как отмечалось ранее, комплексные соединения диссоциирует по типу сильного электролита на комплексоообразователь и ионы внешней сферы. В свою очередь комплексный ион или электронейтральный комплекс диссоциируют по типу слабого электролита на коплексообразаватель и лиганды.
Пример диссоциации анионного комплекса – гексацианоферрат(II) калия
K4[Fe(CN)6] → 4K+ + [Fe(CN)6]-4,
[Fe(CN)6]-4 ↔ Fe+2 + 6CN-.
Так как диссоциация комплексного иона является обратимым процессом, то количественно состояние равновесия характеризуется соответствующим значением Кр. Применительно к диссоциации комплексного иона вместо Кр записывают Кн – константа нестойкости 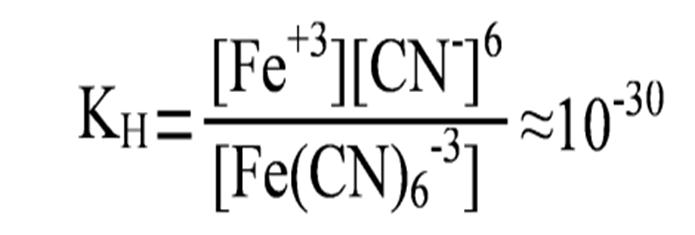 .
.
 2014-02-09
2014-02-09 19560
19560
