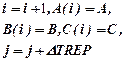Для математического моделирования любого химического процесса и реактора необходимо знание характера химизма процесса, выявление числа частных реакций в общей структуре химического процесса и численное значение констант скоростей частных реакции К. Все виды реакций можно распределить по трем классам:
· реакции разложения, когда из одного моля вещества образуется несколько молей других веществ с молекулярной массой меньшей, чем у сырья:
 А В + С + …;
А В + С + …;
 В
В

 А С;
А С;
D
· реакции синтеза, когда из двух разных компонентов сырья образуются один или более новых компонентов:
 А + В С + …;
А + В С + …;
· реакция изомеризации:
 А В,
А В,
при этом в зависимости от условий проведения процесса реакция может протекать как по прямому, так и по обратному механизму, реакция также может быть равновесной, например:

 А В.
А В.
Задачей моделирования химического процесса является определение закона распределения концентраций компонентов реакционной смеси во времени процесса  , что позволяет определить продолжительность реакции с позиций технологической направленности изучаемого химического процесса. Эта задача решается путем интегрирования дифференциального уравнения для расчета скорости химической реакции
, что позволяет определить продолжительность реакции с позиций технологической направленности изучаемого химического процесса. Эта задача решается путем интегрирования дифференциального уравнения для расчета скорости химической реакции 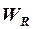 . Скорость химической реакции по компоненту i пропорциональна концентрации исходного компонента реакции j и в общем случае уравнение для расчета скорости химической реакции имеет вид
. Скорость химической реакции по компоненту i пропорциональна концентрации исходного компонента реакции j и в общем случае уравнение для расчета скорости химической реакции имеет вид
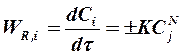 , (1.7)
, (1.7)
где N – порядок химической реакции.
Так, например, для реакции 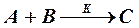 кинетика процесса описывается системой трех уравнений, рассматривающих изменение концентраций каждого из компонентов во времени:
кинетика процесса описывается системой трех уравнений, рассматривающих изменение концентраций каждого из компонентов во времени:
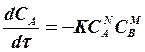
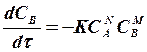 (1.8)
(1.8)
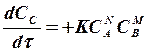
В тех случаях, когда рассматриваемая реакция является сложной и представляет собой совокупность параллельных и последовательных многокомпонентных реакций кинетическая модель имеет форму системы дифференциальных уравнений скоростей химических реакций по каждому компоненту реакционной смеси, при этом если рассматриваемый компонент участвует в нескольких реакциях, то скорость реакции в целом по данному компоненту является суммой скоростей элементарных реакций с участием данного компонента.

 Для решения дифференциальных уравнений кинетики химической реакции необходимо принять начальные и конечные граничные условия интегрирования. Начальные условия при времени реакции
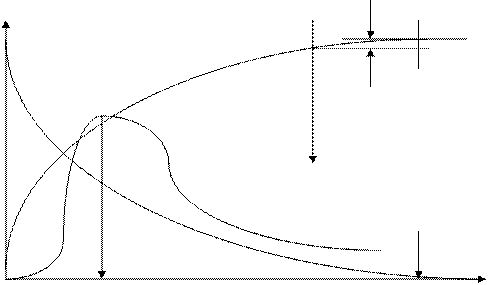
Для решения дифференциальных уравнений кинетики химической реакции необходимо принять начальные и конечные граничные условия интегрирования. Начальные условия при времени реакции 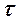 =0 обычно соответствуют заданным начальным концентрациям сырьевых компонентов, а начальные концентрации продуктов реакции приравнивают нулю. Следует учитывать, что если в ходе моделирования кинетики химического процесса выяснится, что продукты реакции необходимо направлять в систему разделения (блоки ректификационных, экстракционных или адсорбционных колонн) для достижения необходимой чистоты целевого продукта процесса, то не прореагировавшие компоненты исходного сырья после их выделения из реакционной смеси возвращаются в реактор (рециркуляционный процесс) с некоторым содержанием продуктов реакции и тогда при повторном моделировании кинетики химического процесса начальные концентрации продуктов реакции станут ненулевыми. Очень важен правильный выбор конечных условий интегрирования, которые ограничивают продолжительность химического процесса. Наиболее характерны три варианта задания конечных условий интегрирования, которые можно проиллюстрировать на кинетике последовательной реакции А В С (рис. 1.4):
=0 обычно соответствуют заданным начальным концентрациям сырьевых компонентов, а начальные концентрации продуктов реакции приравнивают нулю. Следует учитывать, что если в ходе моделирования кинетики химического процесса выяснится, что продукты реакции необходимо направлять в систему разделения (блоки ректификационных, экстракционных или адсорбционных колонн) для достижения необходимой чистоты целевого продукта процесса, то не прореагировавшие компоненты исходного сырья после их выделения из реакционной смеси возвращаются в реактор (рециркуляционный процесс) с некоторым содержанием продуктов реакции и тогда при повторном моделировании кинетики химического процесса начальные концентрации продуктов реакции станут ненулевыми. Очень важен правильный выбор конечных условий интегрирования, которые ограничивают продолжительность химического процесса. Наиболее характерны три варианта задания конечных условий интегрирования, которые можно проиллюстрировать на кинетике последовательной реакции А В С (рис. 1.4):
· целью процесса является получение промежуточного продукта В; тогда условием прекращения процесса можно считать достижение максимальной концентрации компонента В СВ МАХ;
· целью процесса является получение конечного продукта реакции С, концентрация которого асимптотически стремиться к предельному значению; в этом случае на заключительной стадии процесса скорость реакции очень мала и стремится к нулю, что будет приводить к неэффективному использованию объема реактора, и реакцию можно прекратить при достижении такой продолжительности процесса, при которой дальнейшее изменение концентрации 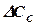 станет незначительным (незначимым) для реализуемого процесса;
станет незначительным (незначимым) для реализуемого процесса;
· целью процесса является уничтожение сырьевого компонента А (например при очистке токсичных выбросов с целью охраны окружающей среды с переводом токсичного вещества А в нейтральные вещества В и С; в этом случае конечное время процесса будет достигаться при снижении концентрации компонента А в продуктах реакции до допустимой величины СА, ДОП.
 |
С
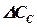
СВ МАХ
СА, ДОП
Рис. 1.5. Варианты нахождения конечных условий

 кинетики химической реакции А В С
кинетики химической реакции А В С
Численное решение дифференциальных уравнений кинетики химической реакции обычно выполняется методами Рунг-Кутта различных порядков. Наиболее простым по алгоритму решения является метод Эйлера (метод Рунге-Кутта первого порядка). В этом методе ось времени сканируется с постоянными шагами интегрирования 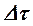 и концентрация I -го компонента на N +1 шаге рассчитывается по его концентрации на N -м шаге и значению скорости реакции на N -м шаге по рекуррентному соотношению
и концентрация I -го компонента на N +1 шаге рассчитывается по его концентрации на N -м шаге и значению скорости реакции на N -м шаге по рекуррентному соотношению
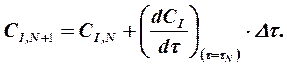 (1.9)
(1.9)
Точность решения задачи зависит в первую очередь от величины шага интегрирования по времени 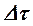 , поэтому обычно задачу решают несколько раз с последовательно уменьшающимися шагами интегрирования (что приводит к увеличению продолжительности расчета задачи) до приемлемого совпадения результатов расчетов для последних двух вариантов решения задачи.
, поэтому обычно задачу решают несколько раз с последовательно уменьшающимися шагами интегрирования (что приводит к увеличению продолжительности расчета задачи) до приемлемого совпадения результатов расчетов для последних двух вариантов решения задачи.
В качестве методического примера рассмотрим расчет кинетики


 изотермической химической реакции А В C, где
изотермической химической реакции А В C, где 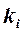 – константа
– константа
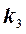
скоростей частных реакций. Реакции 1,2 – первого порядка, реакция 3 – второго порядка. Целевой компонент реакции – В. Известны начальные концентрации Сi компонентов системы при времени t = 0; САо = 20 г/л, СВо =0, ССо = 0 и значения констант ki. Определить продолжительность реакции tр, при которой обеспечивается максимальный выход целевого компонента (рис.1.6).
Математическая модель кинетики реакции имеет вид

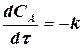
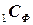
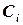
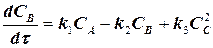 (1.10)
(1.10)
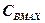
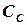
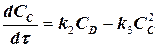
и решается по методу Эйлера по СВ
рекуррентному соотношению СА
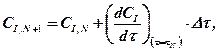 (1.11)
(1.11)
DtREP tP t
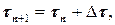 (1.12)
(1.12)

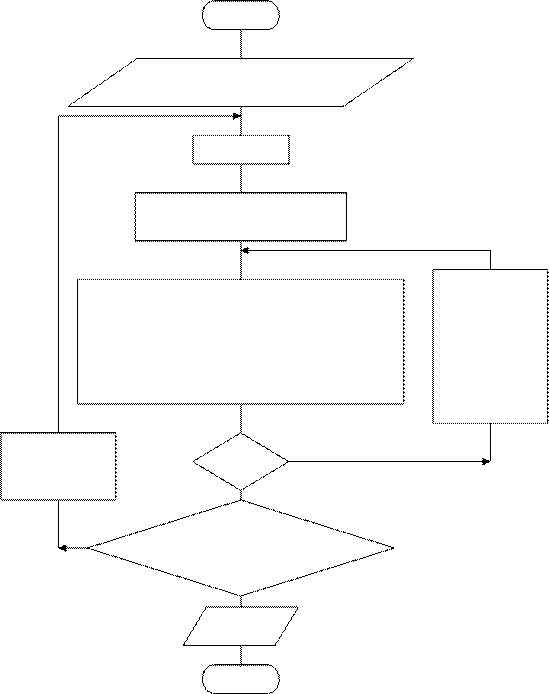
 где Dt – шаг интегрирования. На рис. Рис. 1.6.Кинетические кривые 1.7 приведена блок– схема решения реакции А В С:
где Dt – шаг интегрирования. На рис. Рис. 1.6.Кинетические кривые 1.7 приведена блок– схема решения реакции А В С:
 задачи в общем виде, где концентра- – реперные точки,
задачи в общем виде, где концентра- – реперные точки,
ции компонентов Сi, представленыx DtREP – шаг реперных точек
как А,В,С для предыдущих (n-x) рас-
четов и как А1, В1, С1 для последующих (n+1-x) расчетов. При достижении максимальной величины концентрации В, равной СВМАХ, решение задачи прекращается.
Поскольку точность решения задачи по методу Эйлера зависит от величины шага интегрирования (чем меньше шаг, тем точнее решение, но больше продолжительность расчета) рассмотрим принципы автоматического обеспечения правильности расчета, задав погрешность определения концентрации СВ, равную DС.DС можно принять равной погрешности экспериментального определения концентрации СВ, например, с помощью хроматографа, или принять на уровне 1-0,1 % от величины СВ, например: DСВ = 0,001× СВ.
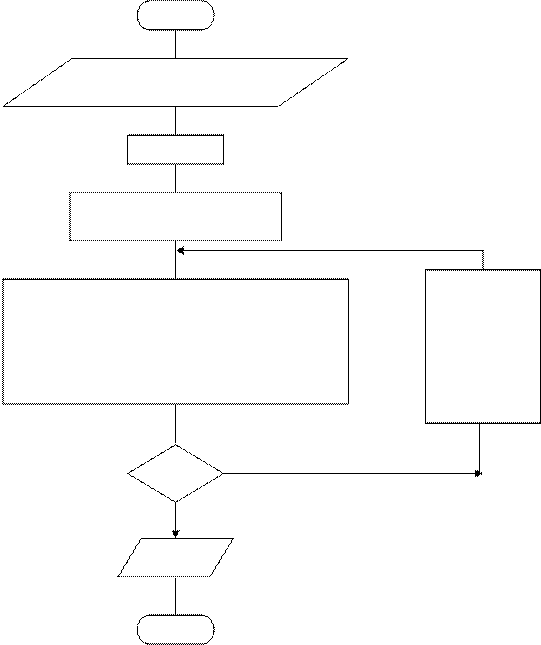 |
Начало
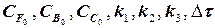
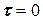
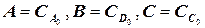
4 6
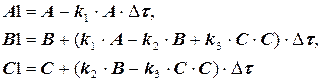
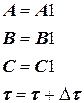
5 да
нет
Конец
Рис. 1.7. Блок-схема расчета кинетики химической реакции
в наиболее общем виде
 В число исходных данных вводится произвольно малое значение ВМАХ, например, ВМА Х = 0. После определения лучшей концентрации компонента В в ходе расчета кинетики с шагом Dt и сравнения В с ВМАХ (рис. 1.8) расчет полностью повторяют с уменьшенным в 2-10 раз шагом интегрирования (например, Dt = Dt /5) до приемлемого совпадения В и АМАХ. Как видно из рис. 1.8, получение верного решения достигается дополнением блок-схемы принципиального решения (рис. 1.7) всего двумя блоками (8 и 9).
В число исходных данных вводится произвольно малое значение ВМАХ, например, ВМА Х = 0. После определения лучшей концентрации компонента В в ходе расчета кинетики с шагом Dt и сравнения В с ВМАХ (рис. 1.8) расчет полностью повторяют с уменьшенным в 2-10 раз шагом интегрирования (например, Dt = Dt /5) до приемлемого совпадения В и АМАХ. Как видно из рис. 1.8, получение верного решения достигается дополнением блок-схемы принципиального решения (рис. 1.7) всего двумя блоками (8 и 9).
Начало
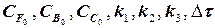
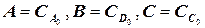
4 6
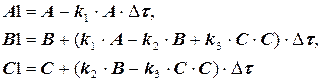
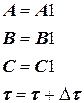
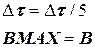
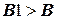
8 нет да
нет 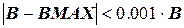
да
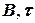
Конец
Рис. 1.8. Блок-схема решения примера 1 с автоматическим обеспечением правильности решения
Недостатками рассмотренного решения задачи являются:
– совпадение значения В = ВМАХ при различных шагах интегрирования может быть формальным (случайным) и полная гарантия правильности расчета кинетики обеспечивается лишь при совпадении кинетических кривых при различных значениях шага интегрирования Dt;
– решение не позволяет рассмотреть кинетику решения задачи в целом, ибо значения концентраций компонентов не выводятся на печать или дисплей.
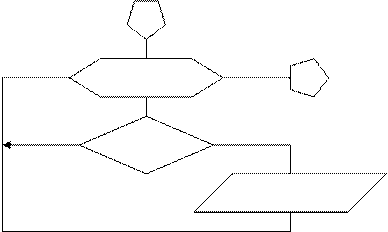
Очевидно, для устранения этих связанных друг с другом недостатков необходимо результаты расчета выводить на печать и сравнивать между собой при различных значениях шага интегрирования. Чтобы избежать операций с чрезмерным объемом информации (например, при шаге 0,0001 и tР = 1с придется проанализировать до 30000 значений концентраций компонентов А, В и С при каждой вариации шага интегрирования Dt), будем подвергать анализу значения концентраций компонентов А, В, и С только в реперных точках, сканирующих область исследования с большим шагом DtREP>>Dt (рис. 1.6), при этом дробление шага интегрирования Dt в ходе поиска правильного решения следует брать таким, чтобы в DtREP всегда укладывалось целое число Dt. Достаточно взять 5-10 реперных точек для достаточно полной информации о кинетике и, например, при tР = 1 мы будем анализировать 15¸30 значений концентраций компонентов А.В.С вместо 30000 значений.
Для обеспечения вывода информации только в реперной точке, когда фактическое время реакции совпадает с позицией реперной точки, можно воспользоваться двумя приемами:
а) если продолжительность реакции tр примерно известна, то приняв DtREP, можно сделать следующую вставку между блоками 4 и 5 на рис. 1.7 и 1.8; во вставке j – время по оси реперных точек:
 4
4
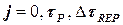 5
5
да
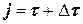
нет
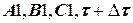
б) если tр неизвестна, то вставка между блоками 4 и 5 примет вид
 |









 4
4

нет
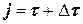 5
5
да
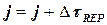
а в блоке 2 (блок начала расчета) следует, кроме 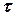 = 0, ввести j = DtREP.
= 0, ввести j = DtREP.
Для получения правильного решения необходимо сформировать и сохранить в памяти массивы значений концентраций А (i), В (i), С (i), выводимых в i – х реперных точках при шаге Dt, и также сохранить в памяти предыдущие массивы концентраций А0 (i), В0 (i), С0 (i), полученные ранее при большем Dt.
Массивы А0 (i), В0 (i), С0 (i) следует ввести в число исходных данных (рис. 1.9), значения А0 (i), В0 (i), С0 (i) могут быть произвольными, например, равными 0, так как после первоначального решения задачи с шагом Dt и получением массива значений концентраций А(i), В(i), С(i) в реперных точках и естественного несовпадения значений элементов массивов А0 (i) и А(i), В0 (i) и В(i), С0 (i) и С(i) выполняется переадресовка массивов и дробление шага интегрирования аналогично блок-схеме на рис. 1.8 до тех пор, пока кинетические кривые, рассчитанные с различными шагами интегрирования, не совпадут с заданной погрешностью расчета Е (например, Е = 0,01×(СА(i)) для всех реперных точек по каждому компоненту. В результате решения задачи выведутся на печать достаточно достоверные значения А(i), В(i), С(i) в реперных точках, оптимальное время tОРТ и максимальный выход компонента В = ВМАХ.
Если число реперных точек N взято с избытком, то после достижения максимальной концентрации компонента В остальные дальнейшие реперные точки сохраняют нулевое значение и в анализе практически не участвуют.
Таким образом, в данном примере расчета кинетики химической реакции рассмотрен ряд иерархических уровней решения задачи с ее последовательным информационным усилением.




 Начало
Начало
 | |||
 | |||

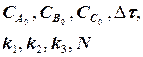
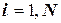
 |
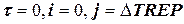

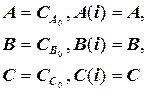

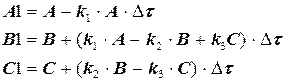

 нет да
нет да


|

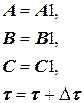
да
Рис.1.9. Блок-схема расчета кинетики

 реакции А В С
реакции А В С
с автоматическим обеспечением пра-
вильности решения и выводом данных
по кинетике реакции в реперных точках
 2015-07-14
2015-07-14 1813
1813