Hm(KO)n (KO)n – кислотный остаток
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуется только катион водорода.
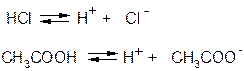
Основность кислоты определяется числом катионов водорода, которые образуются при диссоциации кислот.
HCl, HNO3 – одноосновные кислоты (образуется один катион водорода);
H2S, H2CO3,H2SO4 – двухосновные кислоты;
H3PO4, H3AsO4 – трёхосновные кислоты.
По составу кислоты делятся на бескислородные и кислородсодержащие кислоты.
Название кислородсодержащих кислот строят от названия неметалла с прибавлением окончания –ная, -вая.
Название бескислородных кислот производят от названия неметалла с окончанием –о и
прибавлением слова водородная.
| Формула кислоты | Название кислоты | Название соли |
| HCl | Хлороводородная (соляная) | Хлориды |
| HBr | Бромоводородная | Бромиды |
| HF | Фтороводородная | Фториды |
| HI | Иодоводородная | Иодиды |
| H2S | Сероводородная | Сульфиды |
| H2SO3 | Сернистая | Сульфиты |
| H2SO4 | Серная | Сульфаты |
| HNO2 | Азотистая | Нитриты |
| HNO3 | Азотная | Нитраты |
| H3PO3 | Фосфористая | Фосфиты |
| H3PO4 | Фосфорная | Фосфаты |
| H2SiO3 | Кремневая | Силикаты |
| H2CO3 | Карбоновая (угольная) | Карбонаты |
| CH3COOH | Уксусная | Ацетаты |
| H2C2O4 | Щавелевая | Оксалаты |
Если элемент образует несколько оксидов, то как определить какому оксиду соответствует кислота?
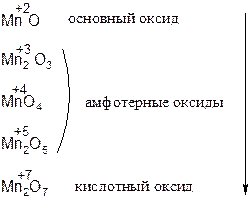
Чем больше степень окисления элемента, тем большие кислотные свойства он проявляет.
Если элемент образует несколько различных по составу кислот, то при увеличении степени окисления увеличивается сила кислоты.
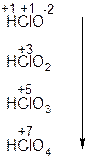
 2015-07-14
2015-07-14 799
799








