Окислительная Восстановительная
форма форма
H+
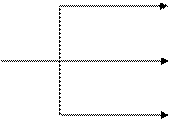 Mn2+ - бесцветный раствор
Mn2+ - бесцветный раствор
H2O
MnO4- MnO2↓ – бурый осадок
OH-
MnO42- - раствор зеленого цвета
При составлении схем полуреакций для окислителя и восстановителя можно использовать следующую таблицу:
| РЕДОКС-РЕАКЦИИ | ||
| pH < 7 кислая | pH = 7 нейтральная | pH > 7 щелочная |
 ок-ль + H+ H2O ок-ль + H+ H2O  вос-ль + H2O H+ вос-ль + H2O H+ |  ок-ль + H2O 2OH- ок-ль + H2O 2OH-  вос-ль + H2O H+ вос-ль + H2O H+ |  ок-ль + H2O OH- ок-ль + H2O OH-  вос-ль + OH- H2O вос-ль + OH- H2O |
| H2O2 | ||
| ок-льH2O2+2H+ + 2е=2H2O вос-льH2O2 – 2е=O2 + 2H+ | ок-льH2O2 + 2е=2OH- вос-льH2O2 – 2е=O2 + 2H+ | ок-льH2O2 + 2е=2OH- вос-льH2O2+2OH--2е=O2+2H20 |
Задание на дом:
1. Используя таблицы "Окислительные свойства бихромата калия" и "Окислительные свойства перманганата калия" составить молекулярные уравнения всех возможных реакций и расставить в них коэффициенты методом полуреакций.
2. Расставить коэффициенты методом полуреакций в следующих уравнениях:
а) Cu + HNO3 (p.) → Cu(NO3)2 + NO↑ + H2O
б) Zn + H2SO4 (k.) → ZnSO4 + SO2↑ + H2O
в) KMnO4 + Na2SO3 + KOH → Na2SO4 + K2MnO4 + H2O
г) KMnO4 + Na2SO3 + H2O → Na2SO4 + KOH + MnO2
 2015-07-21
2015-07-21 1938
1938








