[убрать]
· 1 Передача сигнала
o 1.1 Сигнальный каскад
o 1.2 Интернализация рецептора
o 1.3 Активная и тоническая передача сигнала
· 2 Роль в развитии заболеваний
o 2.1 Лимфомы
· 3 Примечания
Передача сигнала[
Сигнальный каскад [
Передача сигнала от B-клеточного рецептора начинается с узнавания рецептором антигена и агрегации нескольких рецепторов. Ответ клетки на такое узнавание зависит от класса тяжёлой цепи рецептора. В случае В-клеточного рецептора, содержащего тяжёлые цепи класса M (такие рецепторы характерны для наивных B-лимфоцитов), после связывания антигена киназы семейства Src (Lyn, Fyn и Blk) фосфорилируют особые остатки тирозина в цитоплазматических доменах CD79a и CD79b (мотивы ITAM). Белки, содержащие SH2-домены, связываются с фосфорилированными ITAM-мотивами, после чего могут быть активированы. Например, киназаSYK привлекается в мембрану за счёт связывания с фосфотирозином и активируется киназами Src-семейства. SYK инициирует сборку сигнального комплекса, включающего белки CIN85, BLNK, тирозинкиназу Брутона (BTK) и фосфолипазу Cγ2 (PLCγ2). BTK фосфорилирует и активирует PLCγ2, которая, в свою очередь,гидролизует фосфатидилинозитол-4,5-бисфосфат до диацилглицерола и инозитолтрифосфата, что приводит к высвобождению внутриклеточных запасов ионов кальция[4].
После активации B-клеточного рецептора трансмембранный ко-рецептор CD19 также фосфорилируется тирозинкиназой Lyn и привлекает фосфатидилинозитол-3-киназу в рецепторный комплекс. Эта киназа фосфорилирует фосфатидилинозитол-4,5-бисфосфат во внутреннем листке клеточной мембраны с образованием фосфатидилинозитол-3,4,5-трифосфата, с которым связываются белки, содержащие PH-домен, такие как BTK и Akt. В результате передачи сигнала от B-клеточного рецептора активируются сигнальные пути PI3K, Ras, MAPK, NFAT и NF-κB[4].
Интернализация рецептора [править | править исходный текст]
Через несколько десятков секунд после связывания антигена В-клеточный рецептор интернализуется в составе сначала ранних, а затем поздних эндосом. Ранее считалось, что эндоцитоз рецептора приводит к прекращению передачи сигнала от него. Однако исследование 2011 года показало, что рецептор остаётся активным и в эндосомах, и, более того, именно благодаря интернализации достигается его оптимальная функциональная активность. По мнению авторов, В-клеточный рецептор оказывается в разном молекулярном микроокружении в клеточной мембране и эндосомах, и это обеспечивает ещё один уровень контроля за передачей сигнала от него[5].
Активная и тоническая передача сигнала [править | править исходный текст]
Описанный выше сценарий называют «активной» передачей сигнала. Сигнальный каскад В-клеточного рецептора включается в полную силу после того, как наивный B-лимфоцит сталкивается со своим антигеном. В конечном итоге это приводит к пролиферации и созреванию В-лимфоцита в герминативном центре. При активной передаче сигнала в конечном итоге активируется NF-κB. В зрелых В-лимфоцитах передача сигнала от B-клеточного рецептора, хоть и не такая активная, происходит постоянно и необходима для их выживания. Это называется «тонической» передачей сигнала. Предполагают, что тоническая активация сигнального каскада может быть независимой от присутствия антигена. В тонической передаче сигнала большую роль играет PI3K-сигнальный путь и меньшую — NF-κB[4].
Роль в развитии заболеваний[править | править исходный текст]
Лимфомы [править | править исходный текст]
Клетки большинства B-клеточных лимфом сохраняют В-клеточные рецепторы на своей поверхности. При этом многие из них синтезируют рецептор класса M, хотя клетки-предшественники этих лимфом (активированные B-лимфоциты) в норме синтезируют рецепторы класса G. Жизнеспособность таких опухолей, как правило, сильно зависит от активности рецептора, и они оказываются чувствительными к ингибиторам передачи сигнала по этому пути[4]. При этом злокачественные клетки могут полагаться как на так называемую «хроническую активную» передачу сигнала, так и на тоническую. Так, например, в клетках диффузной крупноклеточной B-клеточной лимфомы подтипа ABC (англ. activated B cell-like) постоянно происходит активная передача сигнала от В-клеточного рецептора класса M: опухоль очень чувствительна к потере активности практически любого компонента сигнального каскада (IgH, Igκ, CD79a, CD79b, SYK, BLNK, BTK, PLCγ2, PI3Kδ, PKCβ, CARD11, NF-κB, CBM), а также к его ингибиторам, например, ингибитору тирозинкиназы Брутона, ибрутинибу[6][7]. С другой стороны, лимфома Бёркитта характеризуется тонической передачей сигнала от В-клеточного рецептора: эти клетки чувствительны к потере CD79a/CD79b и SYK, но не CARD11 и BTK и сильнее зависят от PI3K-сигнального пути[4].
Т-клеточные рецепторы (англ. TCR) — поверхностные белковые комплексы Т-лимфоцитов, ответственные за распознавание процессированных антигенов, связанных с молекулами главного комплекса гистосовместимости (англ. MHC) на поверхностиантиген-представляющих клеток. TCR состоит из двух субъединиц, заякоренных в клеточной мембране и ассоциирован с многосубъединичным комплексом CD3. Взаимодействие TCR с MHC и связанным с ним антигеном ведет к активации Т-лимфоцитов и является ключевой точкой в запуске иммунного ответа.
Структура[править | править исходный текст]
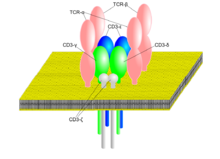

Схема комплекса двух TCR с CD3
TCR представляет собой гетеродимерный белок, состоящий из двух субъединиц — α и β либо γ и δ, представленных на поверхности клетки. Субъединицы закреплены в мембране и связаны друг с другом дисульфидной связью.
По своей структуре субъединицы TCR относятся к суперсемейству иммуноглобулинов. Каждая из субъединиц образована двумядоменами с характерной иммуноглобулиновой укладкой, трансмембранным сегментом и коротким цитоплазматическим участком.
N-концевые домены являются вариабельными (V) и отвечают за связывание антигена, презентируемого молекулами главного комплекса гистосовместимости. В составе вариабельного домена содержится характерный для иммуноглобулинов гипервариабельный участок (CDR). За счет необычайного разнообразия данных участков, различные Т-клетки способны распознавать широчайший спектр различных антигенов.
Второй домен — константный (C) и его структура одинакова у всех субъединиц данного типа у конкретной особи (за исключением соматических мутаций на уровне генов любых других белков). На участке между С-доменом и трансмембранным сегментом имеется остаток цистеина, с помощью которого между двумя цепями TCR образуется дисульфидная связь.
Субъединицы TCR агрегированы с мембранным полипептидным комплексом CD3. CD3 образован четырьмя типами полипептидов — γ, δ, ε и ζ. Субъединицы γ, δ и ε кодируются тесно сцепленными генами и имеют близкую структуру. Каждая из них образована одним константным иммуноглобулиновым доменом, трансмембранным сегментом и длинной (до 40 аминокислотных остатков) цитоплазматической частью. Цепь ζ имеет маленький внеклеточный домен, трансмембранный сегмент, и большой цитоплазматический домен. Иногда вместо цепи ζ в состав комплекса входит цепь η - более длинный продукт того же гена, полученный путем альтернативного сплайсинга.
Поскольку структура белков комплекса CD3 инвариантна (не имеет вариабельных участков), они не способны определять специфичность рецептора к антигену. Распознавание является исключительно функцией TCR, а CD3 обеспечивает передачу сигнала в клетку.
Трансмембранный сегмент каждой из субъединиц CD3 содержит отрицательно заряженный аминокислотный остаток, а TCR – положительно заряженный. За счет электростатических взаимодействий они объединяются в общий функциональный комплекс Т-клеточного рецептора. На основании стехиометрических исследований и измерения молекулярной массы комплекса наиболее вероятным его составом является (αβ)2+γ+δ+ε2+ζ2.
TCR, состоящие из αβ-цепей и γδ-цепей весьма близки по структуре. Эти формы рецепторов по-разному представлены в различных тканях организма.
АДАПТИВНЫЙ (ПРИОБРЕТЕННЫЙ) ИММУНИТЕТ
— ВТОРАЯ (СПЕЦИФИЧЕСКАЯ) ЛИНИЯ ИММУННОЙ ЗАЩИТЫ
Реакции адаптивного иммунитета развиваются сразу же вслед за реакциями воспаления, В организме они сводятся к отбору и быстрому размножению лимфоцитарных клонов, способных специфически распознавать антигены возбудителя. В дальнейшем клетки этих клонов, дифференцируясь, вырабатывают специфически направленные молекулы — антитела, или, специфически распознавая мишени, убивают их.
Антитела резко усиливают эффективность реакции первой линии защиты (фагоцитоза, внеклеточного цитолиза, цитолити-ческих эффектов комплемента и др.) Они повышают «прицель-ностъ» действия этих реакций, указывая направление атаки факторам врожденного неспецифического иммунитета.
Как следует из предыдущего раздела, включение первой линии иммунной защиты основано на проявлении реакций врожденного иммунитета. Развиваются они благодаря древним, эво-люционно закрепившимся механизмам распознавания компонентов возбудителей и материала собственных поврежденных клеток. Для удаления из организма непатогенных и слабовирулентных микроорганизмов этих факторов, по всей видимости, вполне достаточно.
В случае же массивного заражения или высокой вирулентности внедрившихся микроорганизмов в защиту вступает вторая, более специализированная линия обороны.
Включается она практически одновременно с развитием реакций неспецифического, врожденного иммунитета. Однако для ее развития требуется время, поэтому проявляется она несколько позже.
 2015-07-21
2015-07-21 2724
2724








