Атом состоит из ядра и окружающего его электронного "облака", т.е. из электронной оболочки. Электронная оболочка атома - это совокупность элементарных частиц - электронов, каждому из которых присущ корпускулярно-волновой характер.
Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны, входящие в состав ядра, несут положительный заряд.
В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом – нейтральная частица, не несущая заряда.
Атом может потерять один или несколько электронов или наоборот – захватить чужые электроны. В этом случае атом приобретает положительный или отрицательный заряд и называется ионом.
Практически вся масса атома сосредоточена в его ядре, так как масса электрона составляет всего лишь 1/1836 часть массы протона. Плотность вещества в ядре фантастически велика – порядка 1013 - 1014 г/см3. Спичечный коробок, наполненный веществом такой плотности, весил бы 2,5 миллиарда тонн!
Внешние размеры атома – это размеры гораздо менее плотного электронного облака, которое примерно в 100000 раз больше диаметра ядра.
Кроме протонов, в состав ядра большинства атомов входят нейтроны, не несущие никакого заряда. Масса нейтрона практически не отличается от массы протона. Вместе протоны и нейтроны называются нуклонами (от латинского nucleus – ядро).
Электроны, протоны и нейтроны являются главными "строительными деталями" атомов и называются субатомными частицами. Их заряды и массы в кг и в специальных “атомных” единицах массы (а.е.м.) показаны в таблице.
Таблица. Субатомные частицы.
| Частица | Заряд | Масса: | |
| кг | а.е.м. | ||
| Протон | +1 | 1,67·10-27 | 1,00728 |
| Нейтрон | 1,67·10-27 | 1,00867 | |
| Электрон | -1 | 9,11·10-31 | 0,000549 |
Из таблицы видно, что массы субатомных частиц чрезвычайно малы. Показатель степени (например, десять в минус двадцать седьмой степени) показывает, сколько нулей после запятой нужно записать, чтобы получилась десятичная дробь, выражающая массу субатомной частицы в килограммах. Это ничтожнейшая часть килограмма, поэтому массу субатомных частиц удобнее выражать в атомных единицах массы (сокращенно – а.е.м.). За атомную единицу массы принята ровно 1/12 часть массы атома углерода, в ядре которого содержится 6 протонов и 6 нейтронов. Схематическое изображение такого "эталонного" атома углерода приведено на рис. 2-5 (б). Атомную единицу массы можно выразить и в граммах: 1 а.е.м. = 1,660540·10-24 г.
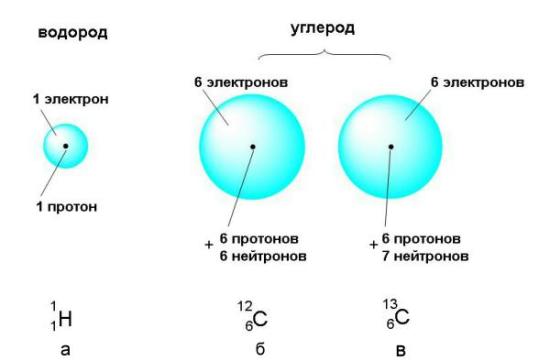
Атомы состоят из положительно заряженного ядра и электронного облака. а) В состав ядра атома водорода входит только 1 протон, а электронное облако заполняется одним электроном. б) В ядре атома углерода 6 протонов и 6 нейтронов, а в электронном облаке – 6 электронов. в) Существует также изотопный углерод, ядре которого на 1 нейтрон больше. Содержание этого изотопа в природном углероде составляет чуть более 1% (об изотопах см. ниже). Линейные размеры атомов очень малы: их радиусы составляют от 0,3 до 2,6 ангстрема (1 ангстрем = 10–8 см). Радиус ядра около 10–5 ангстрема, то есть 10–13 см. Это в 100000 раз меньше размеров электронной оболочки.
Масса атома, выраженная в килограммах или граммах, называется абсолютной атомной массой. Чаще пользуются относительной атомной массой, которая выражается в атомных единицах массы (а.е.м.). Относительная атомная масса представляет собой отношение массы какого-нибудь атома к массе 1/12 части атома углерода. Иногда говорят более коротко: атомный вес.
В российских учебниках пользуются термином относительная атомная масса, которую обозначают символом Ar. Здесь "r" – от английского "relative" – относительный. Например, Ar = 12,0000 – относительная атомная масса углерода 126C равна 12,0000.
 2015-07-21
2015-07-21 1852
1852







