TT - tranzitní teplota, určuje se z inflexního bodu přechodové křivky,je to minimální provozní
teplota
T27 – teplotu určuje minimální požadovaná hodnota nárazové práce, např, KV=27 J
TK0 – tranzitní teplota křehkosti je určena minimální hodnotou KV, která závisí na Re dané
oceli
T50 - určená pro 50% křehkého lomu na lomové ploše
32. Základní termodynamické pojmy, fázové pravidlo, kritérium rovnováhy soustavy
Termodynamická soustava – část hmotného světa, která je předmětem našeho zkoumání
Okolí soustavy – vše, co nepatří do soustavy
Soustavy - otevřené soust. – dochází k výměně hmoty a energie mezi soust. a okolím
- uzavřené soust. – dochází pouze k přenosu energie
Vlastnosti soust.
– extenzivní – závisejí na množství hmoty a jsou aditivní (počet molů, hmotnosti)
- intenzivní – nezávisejí na množství hmoty, v rámci soustavy nejsou
aditivní (teplota, tlak, intenzita mag. pole)
Termodynamická fáze – fyzikálně jednotná část soustavy, která je ohraničená fázovým
rozhraním, na němž dochází k nespojité změně vlastností soustavy.
Je to vlastně stav částí soustavy.
Homogenní soustava – obsahuje jen jednu fázi
Heterogenní soustava – obsahuje více fází
Mezi počtem fází f, které mohou koexistovat v určitém rovnovážném stavu term. soust. a počtem termodynamických složek k, platí Gibbsovo fázové pravidlo f = k + 2 – v
kde v je počet stupňů volnosti, tj. počet vybraných veličin, které se mohou měnit, aniž by vyvolaly fázovou přeměnu.
33. Druhy fází v tuhých kovech a slitinách – dodělat!!!!
Tuhé roztoky dělíme na
– primární - vznikají fázovou přeměnou z tuhé fáze, pokud jsou krystalické, pak mají stejnou
krystalovou mřížku jako jejich základní čistá složka
- sekundární – vznikají fázovou přeměnou za účasti alespoň jedné tuhé fáze, pokud jsou
krystalické, mají úplně jiné krystalické mřížky, než jejich základní složka
34. Krystalizace čistých kovů
Krystalizace lze vyjádřit vztahem 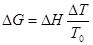 ,
,
Kde DH je entalpie krystalizace, DT přechlazení a T0 rovnovážná teplota krystalizace.
Při konstantním (atmosférickém) tlaku tuhne čistý kov podle Gibbsova pravidla za konstantní teploty. Délka časové prodlevy na křivce chladnutí závisí při této exotermické přeměně na rychlosti přenosu tepla (entalpie tuhnití) ze soustavy do okolí. Ani extrémně rychlým ochlazením nelze krystalizaci čistých kovů potlačit.
35. Alotropické a polymorfní přeměny
K alotrop. přeměnám dochází asi ve 20 kovech, k polyform. Přeměnám v mnoha tuhých roztocích. Nejvýznamnější z nich jsou slitiny Fe a slitiny Ti. Tyto přeměny mohou probíhat vlivem změn teploty a tlaku jak tepelně aktivovaným růstem,tak i astermálním růstem (martensitické přeměny).
36. Binární rovnovážné diagramy s úplnou rozpustností složek, pákové pravidlo
Rovnovážné diagramy lze konstruovat z křivek chladnutí složek a jednotlivých slitin soustavy. Křivky chladnutí čistí složky a binární slitiny s úplnou rozpustností sou na obr.2-38 str. 45 v učebnici.
Je z nich patrné, že tuhnutí slitiny neprobíhá za konstantní teploty jako u čistého kovu, ale v rozmezí dvou teplot. Vynesením teplot počátku tuhnutí získáme l ikvidus ( oblast nad ním je tvořena homogenní taveninou), vynesením teplot konce tuhnutí získáme solidus ( oblast pod ním je tvořena krystaly). Mezi nimi jsou v rovnováze krystaly a tavenina.
To ovšem většinou v praxi neplatí. Poměrná množství obou fází, která jsou během krystalizace v rovnováze, je možno zajistit pomocí
pákového pravidla- Nechť úsečka 345 v obr. Představuje páku. Má-li být tato páka se středem otáčení v bodě 4 v rovnováze, musí platit:
ma. 45 = ml. 34
kde ma je množství tuhého roztoku a, ml je množství taveniny. Je-li celkové množství slitiny úměrné délce úsečky 35 potom pro vzájemný poměr množství obou fází koexistujících při zvolené teplotě platí
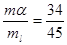
Binární rovnovážný diagram složek A a Bs úplnou rozpustností v kapalném a tuhém stavu a s polymorfní přeměnou bÛa obr.2-39 str. 46
37. Binární rovnovážné diagramy s omezenou rozpustností složek v tuhém stavu + 38.
- digramy s eutektickou přeměnou
- diagramy s peritektickou přeměnou
Eutektická přeměna na obr. 2-45 str. 48
Platí opět pákové pravidlo
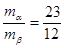
Peritektická přeměna na obr. 2-44 str. 49
Pákové pravidlo
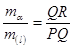
Peritektická přeměna je vratná a lze jji vyjádřit jako a + (l) Û b
39. Binární rovnovážné diagramy s intermediálními fázemi
obr. 2-45 str. 50
Na obr. vzniká při obsahu AnBm intermediární fáze konstantního složení, která rozděluje příslušný diagram na dva diagramy základního typu.
Intermediární fáze b nemá konstantní složení, vyskytuje se v celém koncentračním rozmezí c, tahle fáze také rozděluje diagram na dvě části. V jednotlivých částech diagramu se složky chovají jako v základních diagramech. Když tavenina dosáhne eutektického složení, ztuhne jako eutektikum. Eutektikum E1 je tvořeno směsí krystalů čisté složky A a intermediární fáze AnBm.
40. Křivka ohřevu čistého železa, teploty prodlev, hystereze – dodělat!!!!!
[104, obr. 4.1]
 2015-08-21
2015-08-21 604
604








