Более точно зависимость константы скорости реакции от температуры описывается уравнением Аррениуса:
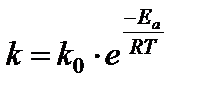 ,
,
Если при изменении температуры концентрация реагентов остается постоянной, то зависимость скорости реакции от температуры описывается уравнением:
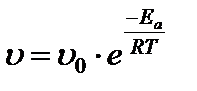 , где
, где
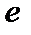 - основание натурального логарифма;
- основание натурального логарифма;
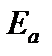 - энергия активации реакции, Дж/моль;
- энергия активации реакции, Дж/моль;
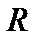 - универсальная газовая постоянная,
- универсальная газовая постоянная, 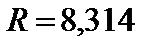 Дж/моль·К;
Дж/моль·К;
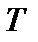 - температура, К;
- температура, К;
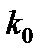 - предэкспоненциальный множитель;
- предэкспоненциальный множитель;
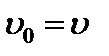 при
при 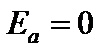 .
.
Энергия активации – это минимальная дополнительная или избыточная энергия по сравнению со средней энергией реагирующих частиц, которой должны обладать соударяющиеся частицы, чтобы вступить в реакцию. Частицы, обладающие такой энергией, называются активными. Энергия активации процесса зависит от природы реагирующих веществ. Значения энергии активации для химических реакций могут составлять от 40 до 200 кДж/моль.
Энергия активации (Еа)показывает, какую минимальную энергию(в расчете на 1 моль) должны иметь частицы, чтобы они могли вступить в реакцию.
- если Еа < 40 кДж/моль, то значительная часть столкновений молекул приводит к реакции и скорость велика.
-если 40 < Еа < 120 кДж/моль скорость удобно меняется.
-если Еа > 180 кДж/моль, то реакция идет очень медленно.
Концентрация Аррениуса иллюстрирует энергетическая диаграмма
Обратной эндотермической реакции:
H2(Г)+J2(Г)  2HJ; ∆H0p(T) = 54 кДж.
2HJ; ∆H0p(T) = 54 кДж.
Распределение Максвелла – Больцмана:
В обычных условиях только часть молекул обладает достаточной энергией, чтобы преодолеть порог. С ростом температуры таких молекул становится больше и скорость реакции возрастает. Известно, что молекулы газа при данной температуре обладают разной кинетической энергией, описываемой распределением Максвелла-Больцмана|:
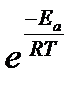 Nакт = Nобщ*
Nакт = Nобщ*
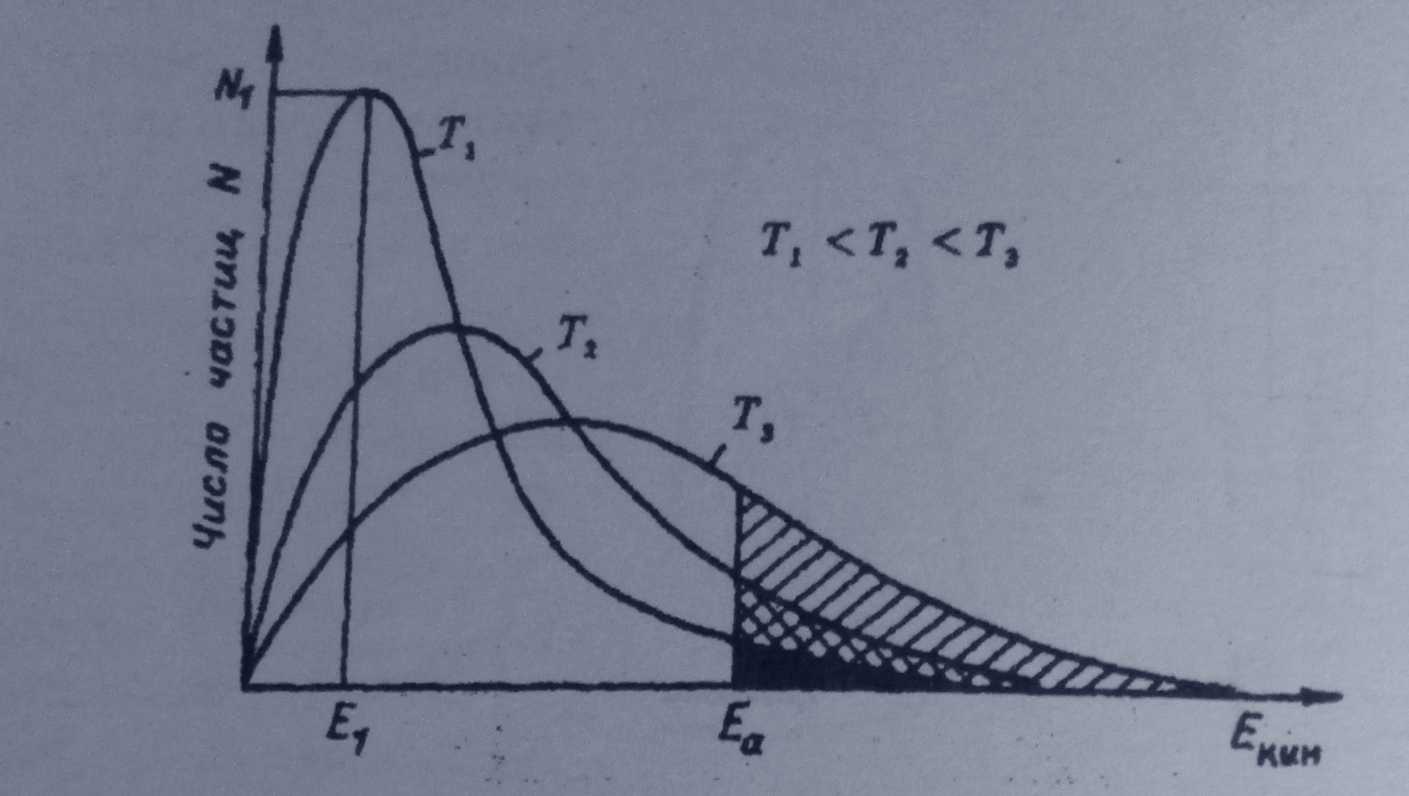
| Графики распределения частиц по энергии для различных температур показывают, что с ростом температуры число таких молекул растет. Более точно зависимость константы скорости химической реакции от температуры описывается уравнением. |
Предэкспоненциальный множитель:
Из уравнения Аррениуса следует, что k =k0 при Еа = 0. Можно было бы предположить, что при этом условии каждое столкновение частиц приводит к химической реакции. Кинетическая теория газов позволяет рассчитать число столкновений частиц в единицу времени (z). Как показывает опыт, не каждое столкновение даже активных молекул приводит к реакции. Необходимо еще одно условие протекания реакции – определенная ориентация молекул, благоприятствующая перераспределению электронной плотности. Поэтому предэкспоненциальный множитель k0 включает в себя фактор ориентации молекул (вероятностный фактор) Рор:
k0 = z *Рор
Вероятностный фактор уменьшается с ростом числа и сложности реагирующих частиц от доли единицы до 10-9.
Таким образом, предэкспоненциальный множитель отражает частоту столкновения и ориентацию реагирующих частиц.
Энергетическая диаграмма химической реакции:
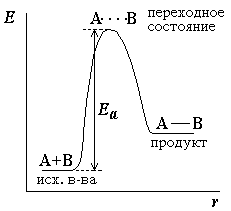
Энергетическая диаграмма для реакции образования продукта АВ из исходных веществ А и В. Если энергия столкновения молекул А и В больше или равна энергии активации Еа, то энергетический барьер преодолевается, и происходит перемещение вдоль координаты реакции r от исходных веществ к продукту. Иначе имеет место упругое столкновение молекул А и В. Вершина энергетического барьера соответствует переходному состоянию (активированному комплексу), в котором связь А–В образовалась частично.
6. Активированный комплекс, его свойства. (пример)
Реакция начинается только между теми частицами, которые обладают повышенной энергией. Такие частицы при столкновении образуют сначала так называемый активированный комплекс (АК). Затем активированный ' комплекс разрушается с образованием продуктов реакции. Образование АК энергетически более выгодна, чем развал всех молекул на атомы и затем образование новых связей.. Свойства АК :,
1)АК не является химическим соединением.
2)АК существует очень короткое время.
3) Для обратимой реакция АК один и тот же для прямой и
обратной реакции.
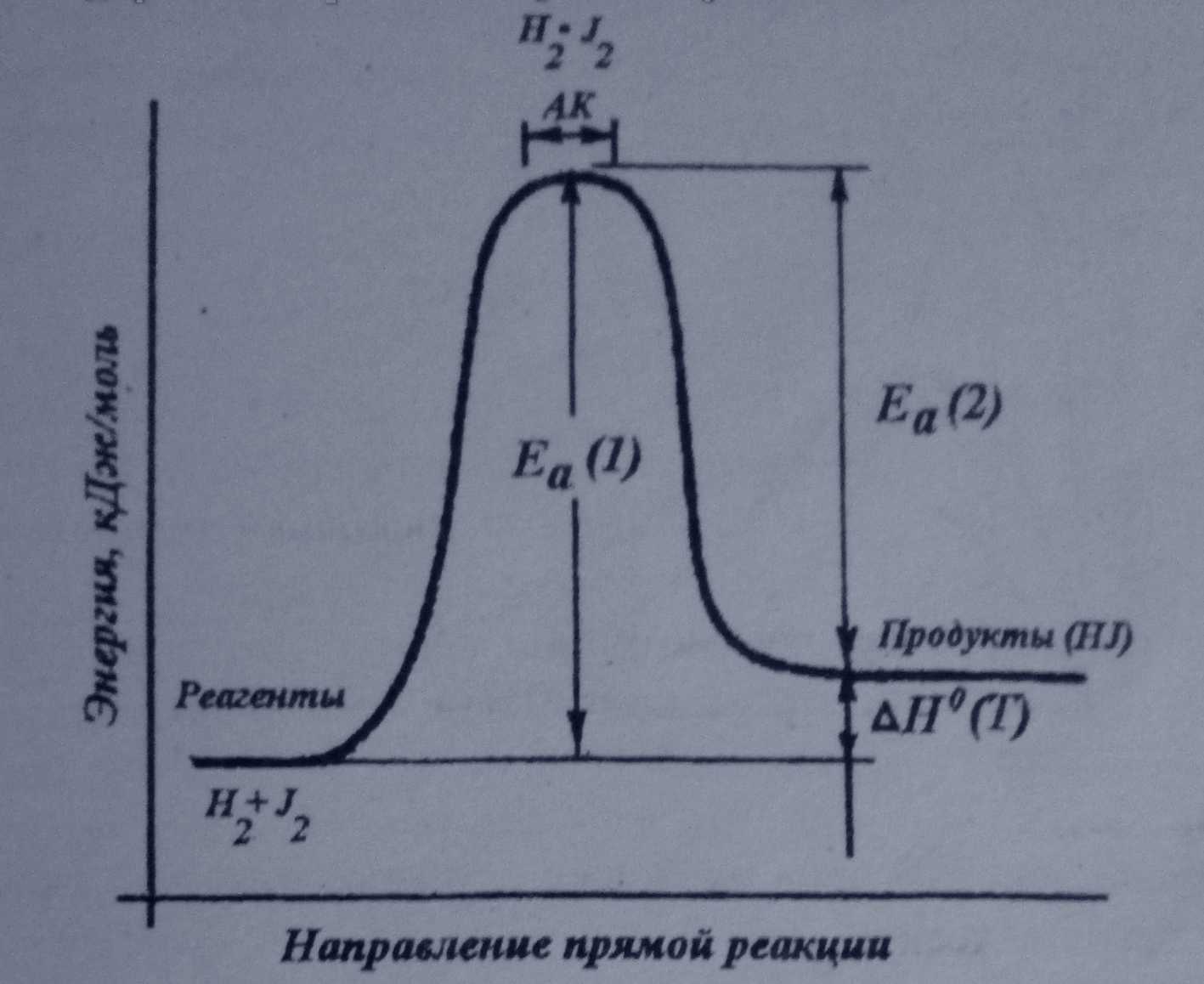
4) Еа реакции равна энергии образования АК.
В реакции Н2 + J2 активированным комплексом является плоский димер H2*J2в котором все связи удлинены по сравнению с молекулами исходных веществ. В обратимых реакциях энергии активации различны для прямой и обратной реакций. Разница между энергиями активации прямой и обратной реакций равна энтальпии реакции (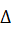 Н0(Т)), Частицы с энергией больше или равной Еа называются активными.
Н0(Т)), Частицы с энергией больше или равной Еа называются активными.
 2015-08-21
2015-08-21 11024
11024
