11.1.1Приготовление 1дм 3 основного стандартного раствора сернокислого калия с содержанием сульфат иона SO4-2 0,5 мг/см 3
Рассчитали какую массу K2SO4 нужно взять, чтобы в ней содержалось 0,5 г сульфат иона.
В 174,2 г K2SO4 – 96 г SO4-2
Х – 0,5 г SO4-2
Х = 0,9072 г
В мерную колбу, вместимостью 1 дм3 вносили 0,9072г K2SO4 и добавляли дистиллированную воду до метки. 1 дм3 раствора содержал 0,5 мг сульфат иона (SO4-2) [8].
11.1.2Приготовление 100 см3 рабочего раствора сернокислого калия с содержанием сульфат иона SO4 0,05 мг/см3
Для приготовления 100 см3 рабочего раствора сернокислого калия с содержанием сульфат иона SO4 0,05 мг/см3 нами был использован приготовленный раствор K2SO4 с содержанием сульфат иона SO4 0,5 мг/см3.
Рассчитали сколько нужно взять основного раствора сернокислого калия с содержанием сульфат иона SO4-2 0,5 мг/см3 чтобы приготовить 100 см3 рабочего раствора с содержанием сульфат иона SO4-2 0,05 мг/см3.
Для этого рассчитали сколько должно содержаться сульфат иона SO4-2 в 100 см3.
В 1 см3 рабочего раствора – 0,05 мг SO4-2
В 100 см3 – X
X = 100 * 0,05 = 5 мг
|
|
|
Нашли сколько см3 нужно взять основного раствора чтобы в нем содержалось 5 мг SO4-2
1см3 основного раствора – 0,5 мг SO4-2
X – 5 мг SO4-2
X = 10 см3
Пипеткой Море взяли 10 см3 основного раствора сернокислого калия с содержанием сульфат иона SO4-2 0,5 мг/см3 в мерную колбу емкостью 100 см3 и довели до метки дистиллированной водой. Затем закрыли пробкой и тщательно перемешали [8].
11.1.3 Приготовление 100 см3 раствора хлористого бария с массовой долей 5 %
Нам было известно:
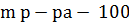 см3=100 г
см3=100 г
W 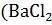 )
) 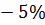
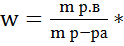 100 (4)
100 (4)
где W – массовая доля вещества, %;
m р. в – масса растворенного вещества, г;
m р – ра – масса раствора, г.
Пользуясь формулой (4) нашли массу раствора хлористого бария
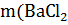 ) =
) = 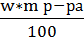 =
= 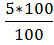 = 5 г
= 5 г
В мерную колбу вместимостью 100 см3 вносили 5 гр BaCl2 и добавляли 2 мл дистиллированной воды. Растворяли. Затем доводили объем до 100 см3. Раствор фильтровали через беззольный фильтр «синяя лента».
11.1.4 Приготовление 500 см3 раствора азотнокислого серебра с массовой долей 1,7 %
Нам было известно:
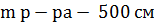 3=500 г
3=500 г
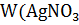 ) – 1,7%
) – 1,7%
Пользуясь формулой (4) нашли массу раствора азотнокислого серебра
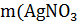 ) =
) = 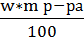 =
= 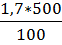 = 8.5 г
= 8.5 г
где W – массовая доля вещества, %;
m р – ра – масса раствора, г;
m р. в – масса растворенного вещества, г.
В колбу вносили 8,5 гр. AgNO3 и добавляли 500 см3 дистиллированной воды. Затем добавляли 0,5 см3 концентрированной азотной кислоты, тем самым подкисляя раствор.
11.1.5 Приготовление 100 см 3 метилового оранжевого с массовой долей 0,1 %
Нам было известно:
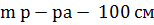 3=100 г
3=100 г
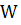 – 0,1%
– 0,1%
Пользуясь формулой (4) нашли массу метилового оранжевого
m(индикатор) 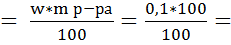 0,1 г
0,1 г
где W – массовая доля вещества, %;
m р – ра – масса раствора, г;
m р. в – масса растворенного вещества, г.
В колбу вносили 0,1 гр. Метилового оранжевого и добавляли 80 мл горячей воды. А по охлаждении доводили объем раствора водой до 100 мл.
|
|
|
11.2 Определение содержания сульфатов в воде из крана внутренней водопроводной сети дома
Для определения содержания сульфатов в воде из крана внутренней водопроводной сети дома применяют турбидиметрический метод [8].
Метод основан на определении сульфат иона в виде BaSO4 в соляно кислой среде с помощью гликолевого реагента. Гликоль, введенный в реакционную смесь при осаждении сульфата бария, стабилизует образующуюся суспензию BaSO4 и делает возможным турбидиметрическое микроопределение сульфатов. Чувствительность метода 2 мг/дм3 SO4 2 – [8].
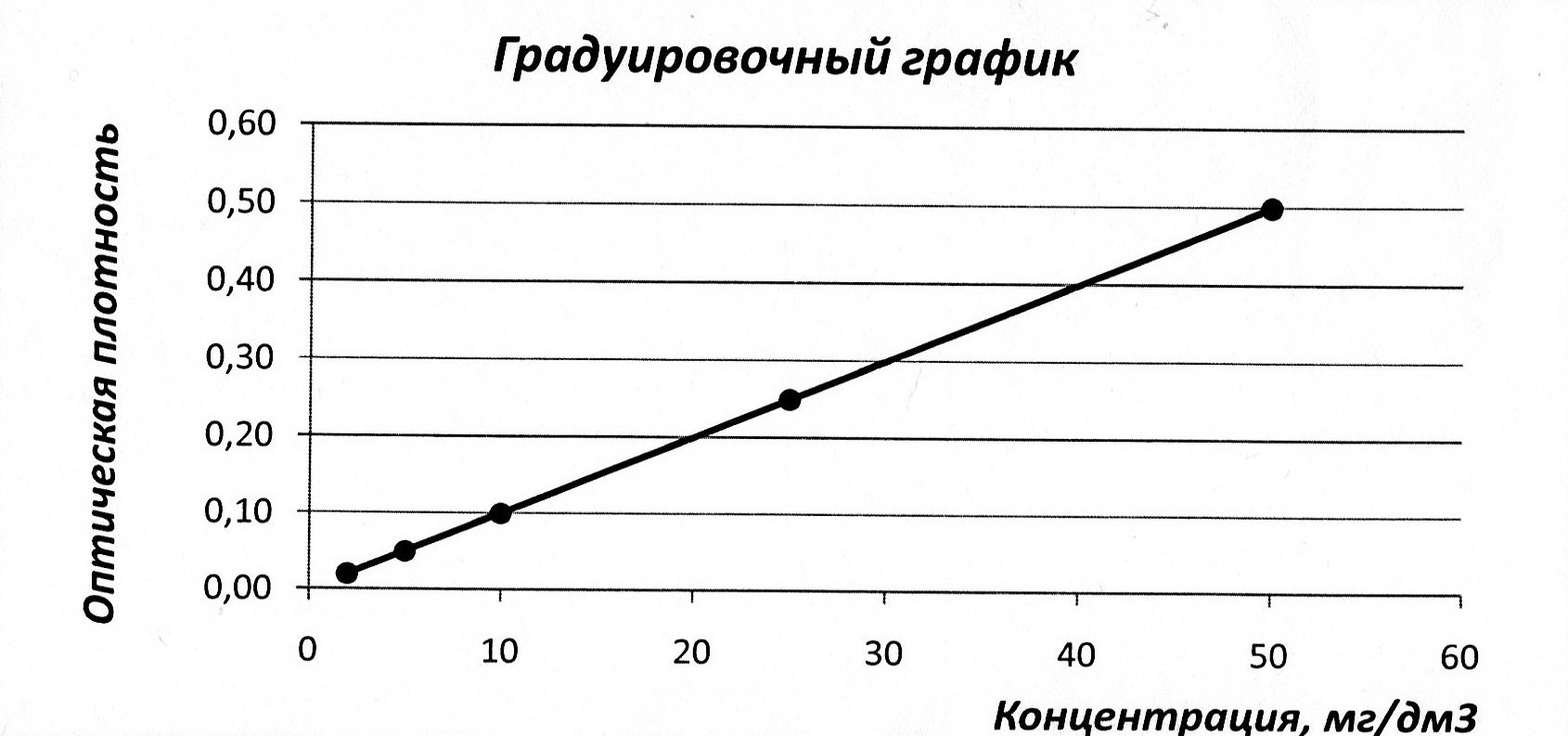
11.2.1 Построение градуировочного графика для определения содержания SO4 2 – мг/см3
Зная оптическую плотность исследуемого раствора по градуировочному графику определили содержание SO4 2 – мг/см3. Содержание сульфатов находили по калибровочной кривой.
Для построения калибровочной кривой в ряд мерных колб вместимостью 50 см3 вносили 0,0; 0,1; 0,2; 0,4; 0,6; 0,8; 1,0; 1,2; 1,4; 1,6; 1,8; 2,0 см3 основного стандартного раствора К2SO4 (0,5 мг SO4 2 - в 1 см3) и доводили объем до метки дистиллированной водой. Приготовленные растворы содержали: 0,0; 1,0; 2,0; 4,0; 6,0; 8,0; 10; 12; 14; 16; 18; 20 мг/дм3 SO4 2 -. Отмеривали по 5 см3 из каждого раствора в мерные цилиндры вместимостью 10 см3 (или в мерные колориметрические пробирки с отметкой 10 см3) [8].
11.2.2 Проведение анализа
К 5 см3 исследуемой пробы или концентрата воды, отобранной в мерный цилиндр вместимостью 10 см3, прибавляли 1-2 капли соляной кислоты (1: 1) и 5 см3 гликолевого реагента, тщательно перемешивали. После 30 мин экспозиции измеряли оптическую плотность раствора фотоэлектроколориметром в кюветах l = 20 мм со светофильтром при длине волны 364 нм. Нами была получена оптическая плотность исследуемой пробы, которая была равна 0,62. Исследуемая проба воды с добавлением гликолевого реагента, приготовленного без BaCl2, является раствором сравнения.
При исследовании пробы воды из крана внутренней водопроводной сети дома на определение содержания сульфатов, нами были получены результаты:
Содержание сульфатов в воде из крана внутренней водопроводной сети дома равно 62 мг/дм3 при нормативе не более 500 мг/дм3. Таким образом, содержание сульфатов в воде из крана внутренней водопроводной сети дома соответствует требованиям ГОСТ 2874-82.
11.3 Определение содержания хлоридов в воде из крана внутренней сети дома
11.3.1 Определение поправочного коэффициента к раствору азотнокислого серебра
В коническую колбу добавляли пипеткой 10 мл раствора хлористого натрия и 90 мл дистиллированной воды, добавляли 1 мл раствора хромовокислого калия и титровали раствором азотнокислого серебра до перехода лимонно-желтой окраски мутного раствора в оранжево-желтую, не исчезающую в течение 15-20 секунд. Полученный результат считали ориентировочным. К оттитрованной пробе добавляли 1-2 капли раствора хлористого натрия до получения желтой окраски. Эта проба являлась контрольной при повторном, более точном определении. Для этого отбирали новую порцию раствора хлористого натрия и титровали азотнокислым серебром до получения незначительной разницы оттенков слабооранжевого в титруемом растворе и желтого в контрольной пробе. Поправочный коэффициент (к) вычисляли по формуле:
K= 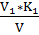 (5)
(5)
где K – поправочный коэффициент;
v1 – объем раствора, израсходованный на титрование, см3;
K1 – коэффициент поправки раствора хлористого натрия;
v – объем раствора, израсходованный на титрование, см3.
При установлении коэффициента поправки использовали не менее трех навесок хлористого натрия.
Получили 3 коэффициента поправки
K1=0,999
K2=1,000
K3=1,001
Коэффициент поправки вычисляли с точностью до четвертого десятичного знака по каждой навеске установочного вещества. Расхождения между коэффициентами не превышало 0,001.
|
|
|
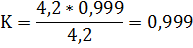
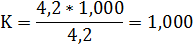
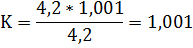
Из вычисленных значений коэффициентов брали среднее арифметическое
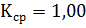
11.3.2 Определение содержания хлоридов в воде из крана внутренней водопроводной сети дома
Метод основан на осаждении хлор-иона в нейтральной или слабощелочной среде азотнокислым серебром в присутствии хромовокислого калия в качестве индикатора. После осаждения хлорида серебра в точке эквивалентности образуется хромовокислое серебро, при этом желтая окраска раствора переходит в оранжево-желтую. Точность метода 1-3 мг/дм3 [8].
При проведении анализа нами было отобрано 100 см3 испытуемой воды. Если вода мутная, ее фильтровали через беззольный фильтр, промытый горячей водой. Отмеренный объем воды вносили в две конические колбы и прибавляли по 1 см3 раствора хромовокислого калия. Одну пробу титровали раствором азотнокислого серебра до появления слабого оранжевого оттенка, вторую пробу использовали в качестве контрольной пробы. При значительном содержании хлоридов образуется осадок AgCl, мешающий определению. В этом случае к оттитрованной первой пробе приливают 2-3 капли титрованного раствора NaCl до исчезновения оранжевого оттенка, затем титруют вторую пробу, пользуясь первой, как контрольной пробой. Содержание хлор-иона (X), мг/дм3, вычисляли по формуле:
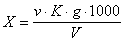 (6)
(6)
где v – количество азотнокислого серебра, израсходованного на титрование, мл;
K – поправочный коэффициент к титру раствора нитрата серебра;
g – количество хлор-иона, соответствующее 1 мл раствора азотнокислого серебра, мг;
V – объем пробы, взятый для определения, мл [8].
На титрование пробы до появления слабого оранжевого оттенка пошло 4,2 мл азотнокислого серебра.
По формуле (6) подставили наши числовые значения
X = 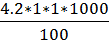 =42
=42
При исследовании пробы воды из крана внутренней водопроводной сети дома на определение содержания хлоридов, нами были получены результаты:
Содержание хлоридов в воде из крана внутренней водопроводной сети дома равно 42 мг/дм3 при нормативе не более 350 мг/дм3. Таким образом, содержание хлоридов в воде из крана внутренней водопроводной сети дома соответствует требованиям ГОСТ 2874-82.
|
|
|
 2015-08-21
2015-08-21 1722
1722








