Условия равновесия. Любой процесс протекает до тех пор, пока не установится состояние его равновесия. Так, жидкость перетекает из сосуда с более высоким уровнем ее в сосуд с более низким уровнем до тех пор, пока уровни жидкости в обоих сосудах не сравняются. Тепло передается от более нагретого тела к менее нагретому до тех пор, пока температура обоих тел не станет одинаковой. Соль растворяется в воде до тех пор, пока раствор не станем насыщенным. Подобных примеров можно привести бесчисленное множество. Условия равновесия характеризуют так называемую статику процесса и показывают пределы, до которых может протекать данный процесс.
Условия равновесия выражаются разными законами; к ним относятся второй закон термодинамики и законы, характеризующие соотношение между концентрациями компонента в различных фазах системы.
Скорость процесса. Если какая-либо система не находится в состоянии равновесия, то обязательно возникает процесс, стремящийся привести эту систему к равновесию. При этом обычно скорость процесса тем больше, чем больше отклонение системы от состояния равновесия. Отклонение системы от состояния равновесия выражает, таким образом, движущую силу процесса. Следовательно, чем больше движущая сила, тем больше скорость процесса. По мере приближениями равновесию движущая сила и скорость процесса уменьшаются, достигая нуля в состоянии равновесия. Вблизи состояния равновесия скорость процесса весьма мала и продолжает уменьшаться при приближении к равновесию, поэтому для его достижения требуется бесконечно большое время. Однако обычно может быть сравнительно быстро достигнуто состояние, столь близкое к равновесию, что практически его можно рассматривать как равновесное.
Для практических расчетов весьма важно знать скорость процесса в различных его стадиях, или так называемую кинетику процесса. Во многих случаях скорость процесса пропорциональна движущей силе. Такая простая зависимость наблюдается при фильтровании, при передаче тепла путем теплопроводности и конвекции, в процессах массопередачи. В этих случаях уравнение скорости процесса имеет следующий вид:
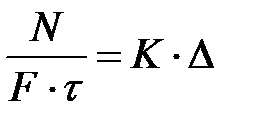 (1)
(1)
где N – количество вещества или тепла, передаваемое через поверхность F за время τ;
К – коэффициент пропорциональности (коэффициент скорости процесса);
Δ – движущая сила процесса.
В тепловых процессах через F обозначают поверхность теплообмена, т. е. поверхность, через которую передается тепло, в процессах массопередачи
F – поверхность соприкосновения фаз.
Левая часть уравнения (1) представляет собой скорость процесса.
Коэффициент скорости процесса К обычно находят опытным путем, расчетное определение его в ряде случаев представляет значительные трудности.
 2015-08-21
2015-08-21 1769
1769








