 При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение вещества, входящих в состав электролитов. На аноде – заряженные ионы отдают лишние электроны (процесс окисления), а на катода + ионы получают недостающие электроны.
При ионной проводимости прохождение тока связано с переносом вещества. На электродах происходит выделение вещества, входящих в состав электролитов. На аноде – заряженные ионы отдают лишние электроны (процесс окисления), а на катода + ионы получают недостающие электроны.
Прохождение тока через электролит сопровождается выделением на электродах составных частей электролита наз электролизом
Законы Фарадея.
Q=Nez
M=N 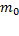
Разделим 2 на 1 получим 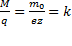
1. Количество вещества, выделившееся на электродах при электролизе, прямопропорционально количеству прошедшего через раствор электричества, т.е. силе тока и времени его прохождения. M = KQ = K I t, где
M - масса выделившегося вещества (г)
Mo-масса одного иона
Q - количество прошедшего электричества в кулонах
I - сила тока в амперах
t - время в секундах
К - электрохимический эквивалент вещества - то количество вещества, которое выделяется одним кулоном.
z-валентность атома\иона вещества
е- зараяд электрона
N- кол-во ионов
2. Количество различных веществ, выделяемых одним и тем же
количеством электричества, прямопропорциональны их химическим
эквивалентам.
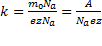 A-атомная масса иона
A-атомная масса иона
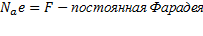 ,
, 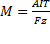
 2015-08-13
2015-08-13 441
441







