ФІЗИКО-ХІМІЧНІ МЕХАНІЗМИ ВИНИКНЕННЯ
МЕМБРАННОГО ПОТЕНЦІАЛУ
Вибіркова іонна проникність клітинних мембран
Перед тим, як перейти до розгляду сучасних уявлень про природу електричної активності клітин, необхідно коротко зупинитися на особливостях взаємодії іонів з молекулами води. Через те, що молекула води є диполем, у розчинах електролітів на взаємодію її молекул з розчиненою речовиною накладається електричне поле. Якщо припустити, що діелектрична проникність води поблизу іона дорівнює 80, то напруженість поля на відстані 0,6 нм від центру одновалентного іона становить 0,5 • 106 В/см. За реальних умов напруженість поля, що діє на перший прошарок молекул води, є принаймні на порядок більшою, тому що при розрахунку енергії взаємодії іона з молекулами води, розташованими безпосередньо біля нього, не можна використовувати макроскопічну діелектричну проникність. На рис. 8.1 схематично зображено гідратований іон Rb+. Гідратовані іони лужних металів обмінюють молекули води приблизно 109 разів за секунду.
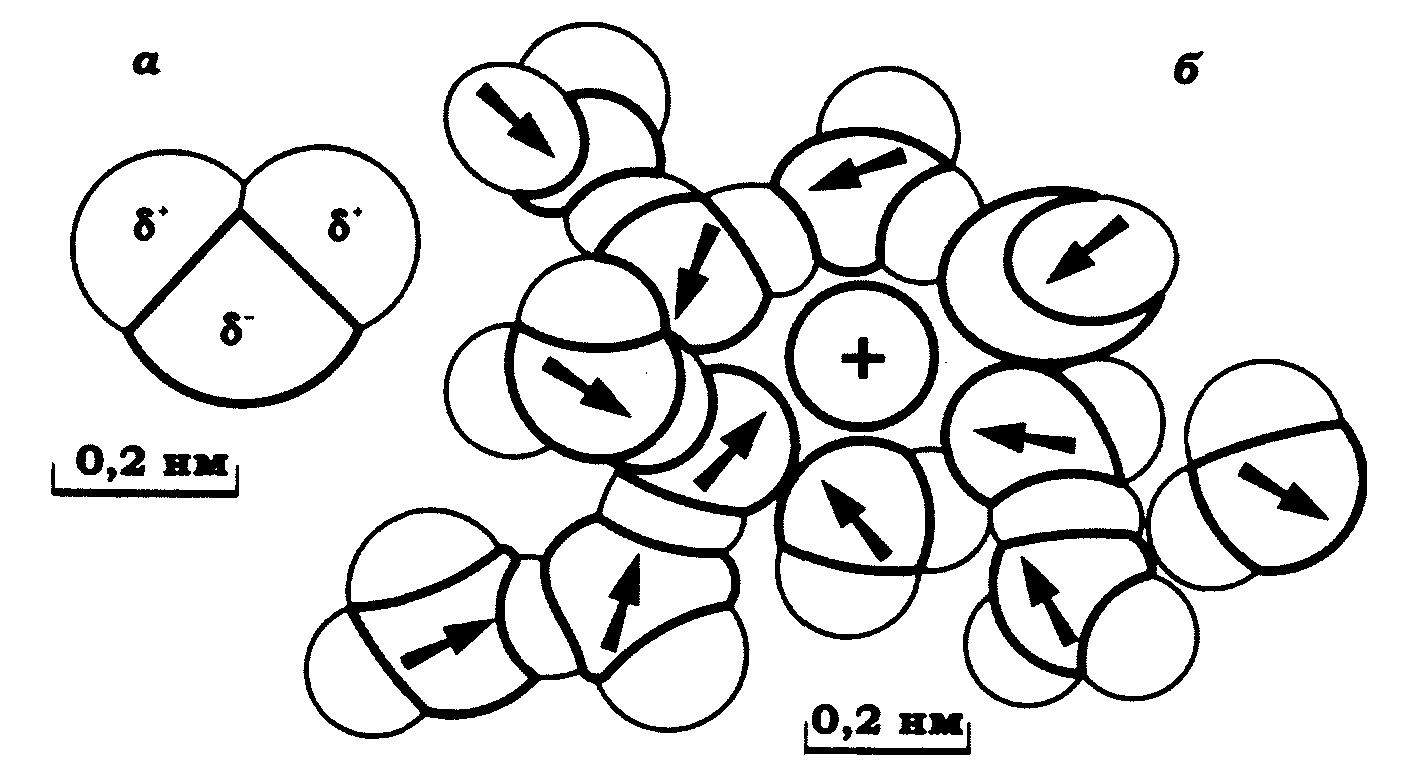
Рис. 8.1. Молекули води й гідратація іона (Б. Хілле, 1984):
а – молекула води з позначеними зарядами атомів водню δ+ і зарядом кисню δ–;
б – гіпотетична структура гідратованого іона Rb+.
Стрілки показують напрямок дипольного моменту молекул води; показано водневі зв'язки між сусідніми молекулами води
Енергія гідратації за однакового заряду іонів залежить від їхніх кристалічних радіусів. Кристалічні радіуси іонів було визначено за методом дифракції рентгенівських променів на кристалах. У різних авторів вони дещо відрізняються. При розгляді гідратації часто використовують радіуси Полінга.
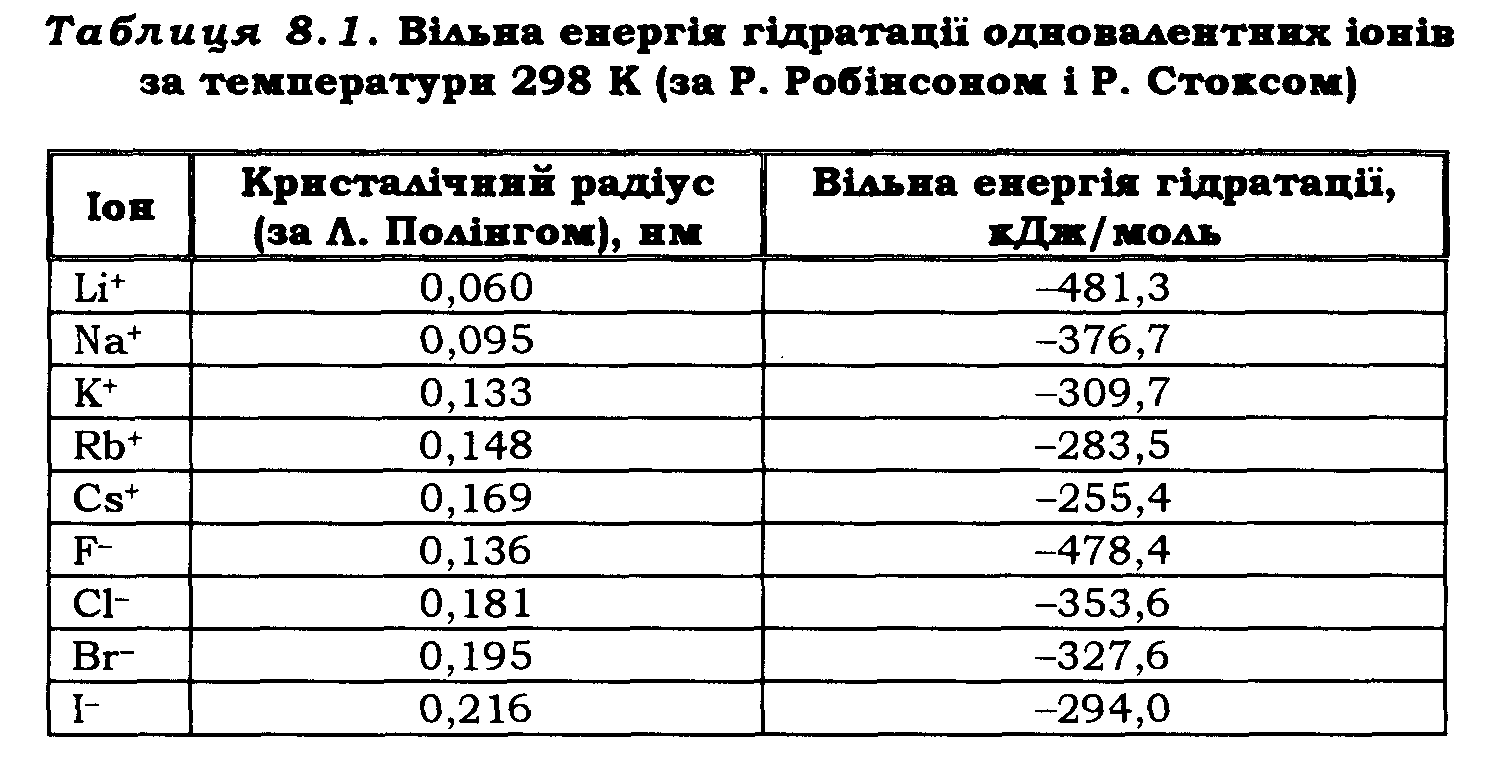
У табл. 8.1 наведено радіуси одновалентних іонів за Полінгом і вільну енергію гідратації. Енергія гідратації для галогенів є значнішою, ніж для катіонів приблизно такого самого радіуса. Рухомість іонів у водних розчинах залежить від їхніх ефективних радіусів у гідратованому стані. Іон з меншим радіусом у гідратованому стані є більше рухомим. Оцінюючи ефективні радіуси гідратованих іонів, нерідко використовують розрахунки за формулою Стокса – Ейнштейна:
kT
r = ———, (8.1)
6π D η
де r – радіус; k – стала Больцмана; Т –абсолютна температура; D –коефіцієнт дифузії; η – в'язкість води. Результати розрахунків за цією формулою є приблизними.
Нині, вивчаючи іонну вибірковість, нерідко використовують електростатичну теорію Ейзенмана. Для пояснення фізико-хімічних механізмів, що лежать в основі вибірковості катіонселективних скляних електродів, Ейзенман розглянув енергетику іонного обміну. У цій моделі для розрахунку зміни вільної енергії застосовувалися електростатична енергія взаємодії катіона з негативно зарядженою (аніонною) групою у склі та енергія гідратації катіонів. Аніонна група розглядалася як сферична. Енергія взаємодії U негідратованого катіона з аніонною групою є обернено пропорційною сумі радіусів аніонної групи rA і катіона rC:
zA zCe2N0
U = ——————, (8.2)
4πεε0(rA + rC)
де zA і zC –валентність аніонної групи й катіона, відповідно; е –елементарний заряд; N0 –число Авогадро; ε – діелектрична проникність скла; ε0 = 8,85 • 10–12 Кл • В–1 • м–1.
Якщо значення rA є досить великим, то аніонні групи створюють слабке електричне поле й величина U буде малою для всіх катіонів. У процесі іонообміну домінуватиме енергія, необхідна для дегідратації. З п'яти іонів лужних металів "великий" іон цезію має найбільшу перевагу, тому що він дегідратується легше порівняно з іншими. Послідовність вибірковості реакції іонообміну відповідатиме першому ряду Ейзенмана і, по суті, – послідовності рухомість гідратованих іонів у водному розчині. Інший випадок, коли значення rA є малим. Аніонне угруповання в цьому разі створює сильне електричне поле, й катіони з меншим кристалічним радіусом мають перевагу. Послідовність вибірковості реакції іонообміну відповідає 11-му ряду Ейзенмана. Для проміжних випадків є дев'ять послідовностей вибірковості.
Таким чином, теорія Ейзенмана передбачає 11 послідовностей вибірковості для п'яти іонів лужних металів:
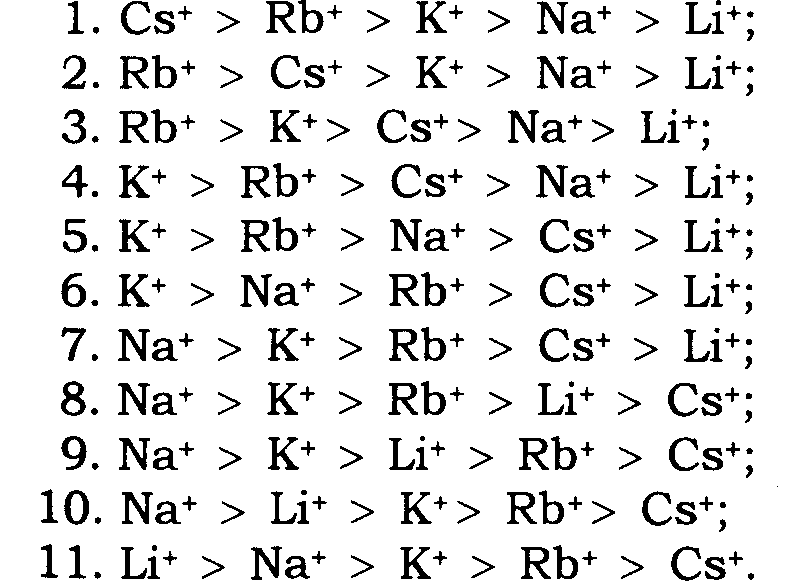
Для характеристики іонної вибірковості плазматичних мембран нерідко використовують коефіцієнти проникності, отримані при розрахунках, що ґрунтуються на теорії постійного поля Гольдмана – Ходжкіна – Катца, а також розрахунки провідності мембрани для різних іонів.
Певні припущення відносно молекулярної структури селективного фільтру потенціалкерованих натрієвих каналів зробив Б. Хілле. Встановлення тривимірної структури калієвого каналу бактеріалної клітини на підставі рентгеноструктурного аналізу (Р. Мак-Кіннон, 1998) дозволило дійти висновку щодо молекулярних основ його провідності й вибірковості.
 2015-08-13
2015-08-13 2279
2279







