Розглянемо такий простий приклад. Нехай ми маємо два розчини КС1 з концентрацією 10 і 100 ммоль/л, розділені проникною для катіонів мембраною (рис. 8.5).
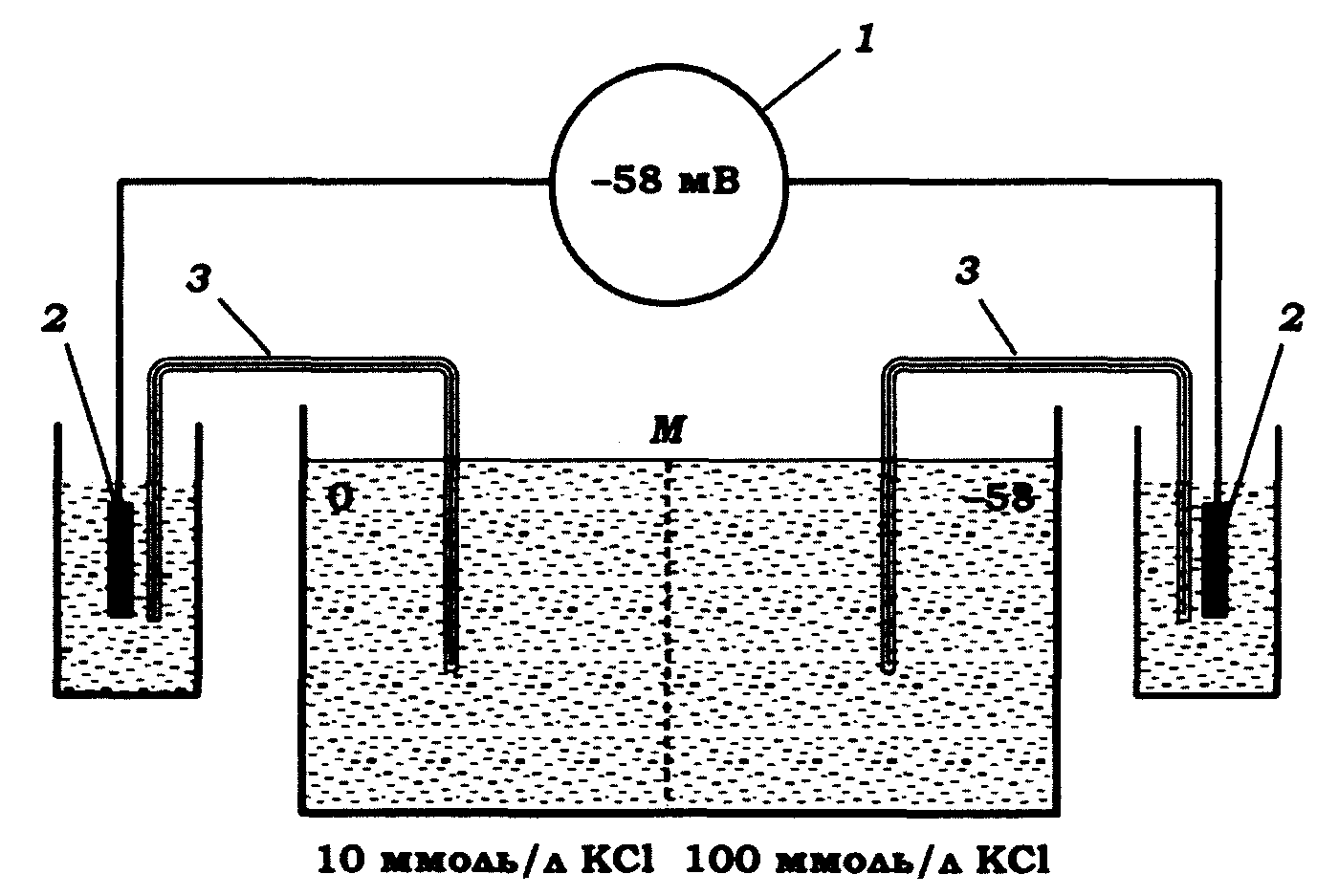
Рис. 8.5. Вимірювання мембранного потенціалу за наявності двох компартментів, заповнених розчином з 10 ммоль/л КС1 і 100 ммоль/л КС1, розділених мембраною М, проникною для іонів калію:
1–вимірювальний прилад; 2–каломельний електрод; 3 – сольовий місток
Цю мембрану може бути виготовлено, наприклад, з катіонобмінної смоли, й вона може мати пори, вздовж яких розташовані фіксовані негативні заряди. Якщо пори є достатньо вузькими й густина фіксованих зарядів високою, через мембрану проходитимуть лише іони калію, переміщаючись від однієї негативно зарядженої ділянки пори до іншої, тоді як аніони хлору внаслідок електростатичного відштовхування не зможуть увійти в пори. За відсутності зовнішнього ланцюга, що з'єднує розчини системою електродів і металевих провідників, через деякий час буде досягнуто іонної рівноваги. Вода не перебуватиме в рівновазі, оскільки під дією осмотичного тиску вона переміщуватиметься з розведеного розчину в більш концентрований. Проте таку рівновагу легко відновити, якщо прикласти відповідний гідростатичний тиск до концентрованого розчину або ввести в розведений розчин неелектроліт, для якого мембрана є непроникною, тобто компенсується осмотичний тиск.
Встановлення рівноваги іонів калію є термодинамічним процесом і зумовлене взаємним урівноваженням рушійних сил у системі. При встановленні рівноваги невеличка кількість іонів калію проходить через мембрану, заряджаючи її й зумовлюючи появу різниці електричних потенціалів, що "врівноважує" градієнт концентрації іонів калію. Електрохімічний потенціал іонів калію за рівноваги має бути однаковим в обох розчинах. Вираз для електрохімічного потенціалу можна записати таким чином:
~
μ = μ0 + RT ln a + zF φ, (8.4)
де μ0 залежить лише від природи розчинника й не залежить від концентрації іона та електричного потенціалу; R –газова стала, вона становить 8,31 Дж • моль-1 • К-1 (або 8,31 Кл • В • моль-1 • К-1, оскільки 1 Дж = 1 Кл • В); Т –абсолютна температура; а – активність, а = fс, де с –концентрація; f – коефіцієнт активності, який у досить розведених розчинах наближається до одиниці (для звичайних фізіологічних розчинів f = 0,76); z –валентність, або кількість елементарних зарядів, що припадають на один іон, з урахуванням знака заряду (для К+ z = +1, для Cl– z= -1, для Са2+ z = + 2 і т.п.); F –число Фарадея, що дорівнює 96500 Кл на 1 моль/л одновалентного іона; φ – електричний потенціал.
Надавши індекс " і " величинам, що відповідають концентрованому розчину, а індекс " о " – величинам, що відповідають розведеному розчину, запишемо умову рівноваги розподілення іонів, валентність яких дорівнює z:
μ0О + RT ln a О + zF φО = μ0 і + RT ln aі + zF φ і, (8.5)
Оскільки для обох розчинів розчинник є той самий (вода), μ0O = μ0 i
RT aо RT aо
φ і – φ о = —— ln — = 2,303 —— lg —. (8.6)
zF aі zF aі
Якщо вважати, що коефіцієнт активності f для обох розчинів є однаковим, вираз (8.6) можна спростити, замінивши активність концентрацією:
RT cо
φ і – φ о = 2,303 —— lg —. (8.7)
zF cі
Добуток 2,303(RТ/F)за кімнатної температури становить приблизно 58 мВ. Стосовно плазматичної мембрани, то φ i - φ о замінюють мембранним потенціалом Е (у даному разі рівноважним). Потенціал зовнішнього розчину φо розглядають як нульовий.
Рівноважну різницю потенціалів можна виміряти мілівольтметром, з'єднаним з розчинами електродами. Зазвичай для цього застосовують електроди порівняння, тобто електроди, вміщені в середовище постійного складу (найпоширеніші з них каломельні електроди) і з'єднані з досліджуваними розчинами за допомогою сольових містків. Місток являє собою концентрований розчин такої солі, що дисоціює на іони, які мають приблизно однакову рухомість (наприклад, хлорид калію). Розчин іммобілізують за допомогою агарового гелю. Дифузійні потенціали, що виникають у ділянці контактів між містками й розчинами, дуже малі, в симетричній системі різниця цих потенціалів є ще меншою. Система, схематично зображена на рис. 8.5, дає змогу виміряти дійсну мембранну різницю потенціалів.
Зазначений принцип вимірювання різниці потенціалів широко застосовується в біології. Так, мікроелектроди являють собою мікромістки з боросилікатного скла, що зазвичай заповнюються КС1 концентрацією 3 моль/л. За допомогою спеціальних мікроманіпуляторів ці електроди вводять у живі клітини й вимірюють різницю електричних потенціалів на клітинній мембрані.
Для визначення величини електричного заряду, який створює даний мембранний потенціал, можна скористатися відомою формулою, відповідно до якої заряд конденсатора дорівнює добутку його ємності на напругу. Узявши, що мембранний потенціал дорівнює 100 мВ (10-1 В), а ємність мембрани становить 1 мкФ/см2 (10-6 Ф/см2), одержимо заряд 10-7 Кл/см2, який відповідає заряду 10-12 моля одновалентних іонів.
Хоч концепція рівноважних потенціалів відіграє значну роль у розумінні та передбаченні зміщень мембранного потенціалу, викликаних змінами проникності мембрани для іонів, за реальних умов існування клітин іонна рівновага спостерігається досить рідко. За цих умов відбуваються пасивні переміщення іонів, зумовлені електрохімічними градієнтами і проникністю мембрани. Для збереження стабільного стану необхідна робота іонних насосів. Для кількісної оцінки пасивних потоків іонів через мембрану та їхньої залежності від іонних градієнтів і проникності мембрани використовують емпіричні формули, що відомі як рівняння Гольдмана - Ходжкіна - Катца.
Вивчаючи іонні механізми виникнення потенціалу спокою, а також різноманітні зміни мембранного потенціалу, необхідно враховувати як особливості іонної проникності клітинної мембрани, так і характер розподілу іонів між внутрішнім вмістом клітини й зовнішнім середовищем. У табл. 8.2 наведено дані про такий розподіл для гігантського нервового волокна кальмара, кравецького м'яза жаби й еритроцитів людини. Зважаючи на те, що плазматична мембрана у стані спокою є проникною не тільки для іонів калію, а й для іонів натрію та хлору, ці іони відіграють певну роль у виникненні потенціалу спокою.
З даних, наведених у табл. 8.2, видно, що потенціал спокою за умов, близьких до фізіологічних, помітно відрізняється від рівноважного потенціалу для іонів калію. У м'язових волокнах і в еритроцитах людини потенціал спокою близький до хлорного рівноважного потенціалу. Ця обставина пов'язана з високою проникністю плазматичної мембрани цих клітин для іонів хлору.
Внутрішньоклітинний кальцій перебуває переважно у зв'язаному стані. Цитозольна концентрація іонізованого кальцію становить приблизно 10-7моль/л.
Таблиця 8.2. Внутрішньо- і зовнішньоклітинна концентрація іонів
(ммоль/л клітинної води чи зовнішнього середовища),
рівноважні потенціали та потенціал спокою
| Показники | Гігантський аксон кальмара | Кравецький м’яз жаби | Еритроцити людини |
| Внутрішньоклітинна концентрація, ммоль/л | |||
| Na+ | |||
| K+ | |||
| Mg2+ | |||
| Cl+ | |||
| Зовнішня концентрація, ммоль/л | |||
| Na+ | |||
| K+ | 2,5 | ||
| Mg2+ | 1,0 | 1,0 | |
| Сa2+ | 2,5 | ||
| Cl+ | |||
| Потенціал рівноваги, мВ | |||
| E Na | + 45 | + 53 | + 55 |
| E K | -73 | -101 | -86 |
| E Cl | -44 | -92 | -9 |
| Потенціал спокою, мВ | |||
| E | -60 | -92 | від -6 до -10 |
У зв'язку з тим, що потенціал спокою є більш позитивним, ніж; рівноважний потенціал для іонів калію, існує тенденція до виходу іонів калію з клітини й заміщення їх іонами натрію. Для збереження сталості внутрішньоклітинних концентрацій іонів необхідна робота механізмів, що здійснюють активний транспорт іонів.
 2015-08-13
2015-08-13 1707
1707








