Количество растворенной соли остаeтся постоянным. В рассмотренном примере К2SО4 выполняет роль электролита.
Электролиз раствора сульфата цинка с инертными электродами. На катоде одновременно восстанавливаются ионы цинка и молекулы воды (электродный потенциал цинка -0,76 В близок к потенциалу разложения воды -0,41 В). На аноде окисляются молекулы воды и выделяется кислород.
Схема электролиза ZnSО4 —>Zn2+ +SO42-
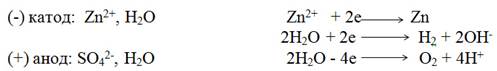
Суммарная схема процесса электролиза
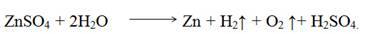
Электролиз раствора нитрата меди с инертными электродами. Стандартный электродный потенциал Сu +0,34 В, поэтому на катоде восстанавливаются ионы Сu2+ и выделяется медь. На аноде окисляются молекулы воды и выделяется кислород. Схема электролиза
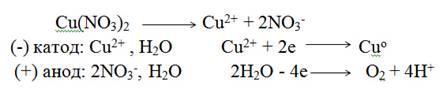
Суммарная схема процесса электролиза

Электролиз раствора сульфата никеля с никелевым анодом. Стандартный электродный потенциал Ni -0,25 В. Он несколько больше, чем потенциал разложения воды (-0,41 В), поэтому на катоде в основном происходит восстановление ионов Ni2+ и выделение металла. На аноде - противоположный процесс - окисления металла, так как потенциал никеля намного меньше потенциала окисления воды (1,23 В) и потенциала окисления SO42- ионов (2,01 В). Электролиз в данном случае сводится к растворению металла анода и выделению его на катоде. Схема электролиза
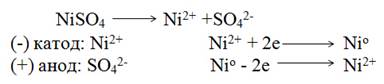
Электролиз может происходить только при определенной разности потенциалов, называемой потенциалом разложения. Потенциал разложения - минимально необходимая разность потенциалов, при которой начинается электролиз данного соединения.
 2015-08-13
2015-08-13 2590
2590








