До баромембранних процесів відносяться: мікро-, ультра-, нанофільтрація та зворотний осмос.
МІКРОФІЛЬТРАЦІЯ
Це найближчий процес до звичайної фільтрації. Розміри мембран від 10 до 0,05 мкм, що дозволяє їх використовувати для очищення розчинів від колоїдів(суспензій та емульсій). Потік через мембрану характеризується законом Дарсі:
I=K∙Δp (1)
K – константа проникності, що залежить від структурних факторів(розмір пор, пористість, розподіл за розмірами). До неї також входить в’язкість проникаючої рідини.
Якщо мембрана складається із прямих капілярів, можна використовувати рівняння Хагена-Пуазейля, де К приблизно дорівнює ε∙R2. ε – пористість, R – радіус пор.
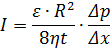
При медулярній структурі(зернистій), що нагадує ансамбль сфери стих частинок, використовується рівняння Козені-Кармана:
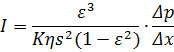
s – площа;
Δx – товщина.
МЕМБРАНИ ДЛЯ МФ:
Для отримання полімерних МФМ використовують методи: спікання та інші термічні методи, витяжка, травлення треків, інверсія фаз. Для неорганічних мембран, які надзвичайно стійкі до агресивних рідин використовують методи спікання, золь-гель технологію.
|
|
|
Органічні та неорганічні матеріали, що використовуються для виготовлення МФМ:
Гідрофобні полімерні мембрани, політетрафторетилен, поліпропілен.
Гідрофільні полімерні мембрани: ефіри целюлози, полісульфони, поліаміди.
Керамічні мембрани – Al2O3, ZrO2, оксид титану, оксид кремнію.
Методи визначення розміру пор мембран: електронна мікроскопія, ртутна порометрія, метод пузиря.
Головна проблема МФ – відкладання осадів на мембрані внаслідок концентраційної поляризації.
Тупикова МФ. Потік рідини, яка подається на мембрану є перпендикулярним до її поверхні, товщина шару зростає зі збільшення шару фільтрації, тангенціально: потік подається паралельно поверхні мембрани.
Використання і параметри МФ:
Мембрани асиметричні чи симетричні пористі. Товщина мембран 1-150 мкм. Розмір пор 0,05-10 мкм. Рушійна сила(менше 0,2 МПа) – різниця тисків. Схема: ситовий стеричний механізм. Мембранні матеріали(полімерні та керамічні).
Використання: в аналітичних цілях, очищення води, освітлення харчових рідин(пиво, соки, вино), концентрування клітин, отримання апірогенної води.
УЛЬТРАФІЛЬТРАЦІЯ
Займає проміжне положення між МФ та ЗО. Розмір пор УФМ: 0,05 мкм до 1 нм.
Границя пор максимального розміру ЗОМ. Як МФМ так і УФМ відносяться до пористих. Має місце однакові мембранні явища і використовується один і той же принцип розділення, але є деякі відмінності: УФМ мають асиметричну структуру і гідродинамічний опір визначається малою долею товщини активного шару(<1 мкм). Тоді як у МФМ – повною товщиною мембрани.
|
|
|
Мембрани для УФ. Більшість промислово виготовлених мембран є полімерними, їх виготовляють методом інверсії фаз з таких матеріалів: полісульфони, поліаміди, похідні целюлози, використовують також керамічні матеріали. УФ мембрани використовують для фракціонування макромолекул: крупніші затримують, мілкіші пропускають.
Параметри та використання УФ: Мембрани пористі асиметричні, товщина = 150 мкм. Розмір пор – 1…100 нм. Рушійна сила тиск 0,1…1 МПа. Принцип розділення – ситовий механізм.
Мембранні матеріали: полімерні, керамічні.
Основне використання: молочна промисловість, обробка молока, сироватки, харчова промисловість(вилучення крохмалю та білків), металургія(розділення емульсій масла у воді), текстильна промисловість(вилучення барвників), фармацевтична(вилучення антибіотиків, ферментів), ЖКГ(очищення стічних вод).
НАНОФІЛЬТРАЦІЯ
НФ – баромембранний процес розділення за якого мембрана затримує частинки і розчинені макромолекули розміром понад 2…3 нм. Експериментальні дані, отримані при дослідженні НФ мембран різних марок засвідчують, що як правило селективні шари заряджені негативно і за низьких концентрацій органічних домішок чітко проявляється ЕХ механізм затримання.
При високих концентраціях електролітів найістотнішим механізмом дії є структурний.
Основною відмінністю НФМ з їх відносно невисоким гідравлічним опором є різна затримуюча здатність для одно- і багатозарядних іонів, що дає змогу селективно розділяти багатокомпонентні розчини. Йони Ca2+, Mg2+ процент затримання 86-92%, а Na+ і Cl- затримуються на 50-55%.
ЗВОРОТНИЙ ОСМОС
У більшості мембранних процесів рушійною силою є різниця тисків чи концентрацій(активностей), які можна об’єднати одним параметром – хімічним потенціалом. μ=f(T, p, a або с). При постійній температурі 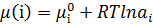 + Vi∙p
+ Vi∙p
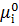 – хімічний потенціал 1 моля чистої речовини при р і Т. Для чистих компонентів а =1, а для рідких сумішей аі = хі∙γі
– хімічний потенціал 1 моля чистої речовини при р і Т. Для чистих компонентів а =1, а для рідких сумішей аі = хі∙γі
хі – мольна доля
γі – коефіцієнт активності.
Для ідеальних сумішей γі=1 і тоді аі = хі. Для більшості неводних сумішей, де спостерігається відхилення від ідеальності використовується активність(а)
Для ідеальних газів: 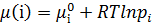 , де
, де 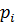 - парціальний тиск.
- парціальний тиск.
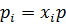
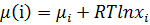 +
+ 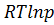
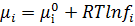 , де
, де 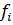 – леткість газу.
– леткість газу.
Осмос – осмотичний тиск виникає при контакті двох розчинів з різною концентрацією(чи розчину і чистого розчинника) розділених напівпроникною мембраною, що є проникною для молекул розчинника і непроникною для нерозчинної речовини. За ізотермічних умов:
Конц. ф. 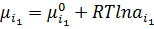 +
+ 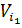 ∙p
∙p
Розб. ф. 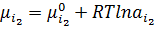 +
+ 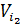 ∙p
∙p
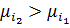 – при різниці концентрацій.
– при різниці концентрацій.
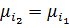 – при рівних концентраціях
– при рівних концентраціях
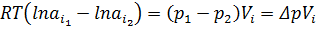
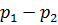 =Δπ =
=Δπ = 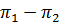 – осмотичний тиск
– осмотичний тиск
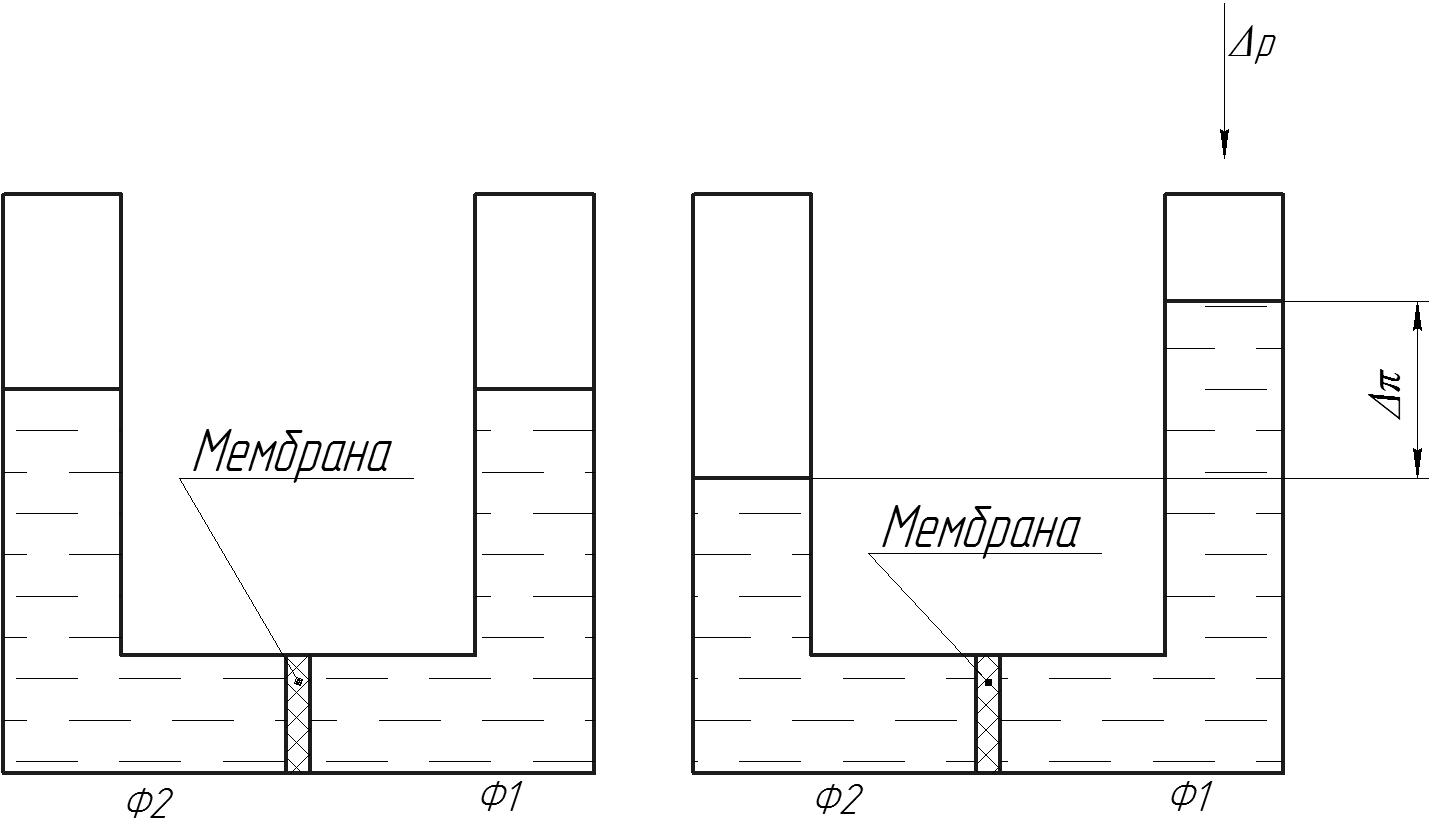
Рис.5
Загальна формула під дією осмотичного тиску
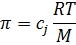
c – концентрація;
j – коефіцієнт іону.
При дисоціації солей число молей збільшується і осмотичний тиск збільшується. При асоціації органічних речовин осмотичний тиск падає. При МФ та УФ осмотичний тиск не враховується.
ЗО використовується, коли необхідно відділити від розчинника НМ розчинні сполуки, яким є органічні і неорганічні солі. В зв’язку з цим для реалізації процесів ЗО потрібні мембрани з меншим розміром пор ніж МФ і УФ. Через це зростає гідродинамічний опір, а значить падає продуктивність. Об’ємний потік:
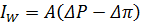
A – константа мембрани;
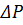 – робочий тиск;
– робочий тиск;
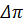 – осмотичний тиск.
– осмотичний тиск.
Коефіцієнт затримки (селективність):
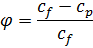
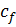 ,
, 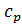 – концентрації пермеату і вихідної води.
– концентрації пермеату і вихідної води.
Селективність зростає зі збільшенням тиску і зменшенням 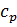 .
.
ЗО МЕМБРАНИ
Потік через ЗО мембрану приблизно зворотно-пропорційний Δ х (товщина), тому більшість мембран є асиметричними з щільним верхнім шаром(до 1 мкн) і пористою основою товщина якої 50-150 мкн). Опір визначається щільним верхнім шаром. Розрізняють 2 типи ЗО мембран з асиметричною структурою:
1. Асиметричні
2. Композиційні
В асиметричних мембранах, як верхній шар так і основа складаються з одного матеріалу. Такі мембрани отримують методом інверсії фаз.
|
|
|
Важливим класом АМ для ЗО, що отримують методом інверсії фаз є ефіри целюлози. Оскільки вони високо проникні для води і низько проникні для солей. Серед інших матеріалів, які часто використовуються для Зо виділяють поліаміди. Ці матеріали мають також високу селективність до солей, але меншу продуктивність. Поліаміди можуть використовуватись в ширшому інтервалі рН 5-9. Головний недолік поліамідів їхня чутливість до хлору, який викликає руйнування амідної групи. Композиційні мембрани утворюють другий тип структур, які часто використовуються в ЗО. У таких мембран верхній робочий шар і розміщена під ним основа виготовлені із різних полімерних матеріалів, що дозволяє оптимізувати кожний шар окремо. Часто як основи для ЗО мембран використовують УФ мембрани. Більшість композиційних мембран отримують методом міжфазної полімеризації.
ВИКОРИСТАННЯ ЗО
В принципі ЗО може мати широкий спектр використання, де можна розглядати як очищення розчинника(продукт – пермеату), так і концентрування розчиненої речовини(продукт – ретентат).
Основне використання ЗО: знесолення мінералізованих вод і особливо морської води до питної води. Інша важлива область – виробництво ультра чистої води для напівпровідникової промисловості.
ПАРАМЕТРИ ТА ВИКОРИСТАННЯ
Мембрани: асиметричні чи композиційні.
Товщина: основа 150 мкн, верхній шар біля 1 мкн. Розмір пор <2 нм.
Рушійна сила: тиск. Для солонуватої води – 1,5-2 МПа(ЗО низького тиску)
2,5-3МПа – ЗО середнього тиску, 4-8 МПа – морська вода(ЗО високого тиску)
Фірма DDS 10-12 МПа.
Принцип розділення: розчинення – дифузія.
Мембранний матеріал: похідні целюлози, ароматичні поліаміди(бояться хлору), поліуретанові ефіри.
Основне використання: знесолення солонуватих вод, морської води, отримання ультра чистої води, концентрування харчових соків, концентрування молока.
ЗО - процес розділення розчинів за допомогою напівпроникної мембрани, що пропускає розчинник і затримує розчинені речовини під дією робочого тиску, який перевищує осмотичний тиск розчину. У тому випадку, коли прикладений тиск більше осмотичного, концентрований розчин тече в сторону розбавленого. Водний потік можна виразити рівнянням, якщо допустити, що розчинена речовина не проходить крізь мембрану.
|
|
|
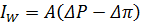
А – коефіцієнт проникності.
На практиці ЗО мембрана може бути слабо проникною для НМС, тоді реальна різниця осмотичного тиску буде не 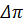 , а σ, де σ – коефіцієнт відбиття мембраною розчиненого компоненту. При R <100% i σ< 1
, а σ, де σ – коефіцієнт відбиття мембраною розчиненого компоненту. При R <100% i σ< 1
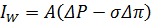
Для води коефіцієнт А – константа для даної мембрани і включає наступні параметри.
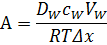
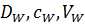 – відповідно коефіцієнти дифузії, концентрація і об’єм води, що пройшов крізь мембрану.
– відповідно коефіцієнти дифузії, концентрація і об’єм води, що пройшов крізь мембрану. 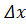 – товщина мембрани.
– товщина мембрани.
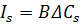 – потік розчиненої речовини.
– потік розчиненої речовини.
В – коефіцієнт проникності для розчиненого компонента.
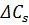 – різниця концентрацій розчиненого компоненту з обох сторін мембрани.
– різниця концентрацій розчиненого компоненту з обох сторін мембрани.
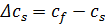
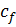 – вихідна концентрація;
– вихідна концентрація;
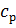 – концентрація пермеату.
– концентрація пермеату.
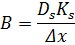
 – коефіцієнти дифузії та розчинності речовини.
– коефіцієнти дифузії та розчинності речовини.
 – товщина мембрани.
– товщина мембрани.
Можна бачити, що  збільшується лінійно із зростанням тиску.
збільшується лінійно із зростанням тиску. 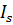 – мало залежить від тиску.
– мало залежить від тиску.
Селективність ЗО мембрани визначається коефіцієнтом затримки.
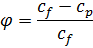
За граничних умов, коли 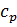 → min, а
→ min, а 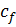 → max отримуємо
→ max отримуємо 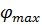 . Враховуючи, що
. Враховуючи, що 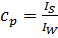
ВПЛИВ РІЗНИХ ЧИННИКІВ НА БАРОМЕМБРАННІ ПРОЦЕСИ
Робочий тиск
Вибір робочого тиску залежить від виду процесу так концентрації розділюваного розчину, типу використаних мембран, конструкції апарату, гідравлічного опору між мембранного каналу і дренажу. Для ЗО робочий тиск складає 3-10 МПа, для УФ 0,3-1 МПа, МФ – 0,03-0,1 МПа.
У результаті дії високого тиску на полімерну, наприклад на асиметричну АЦ мембрану спостерігається значна залишкова деформація.
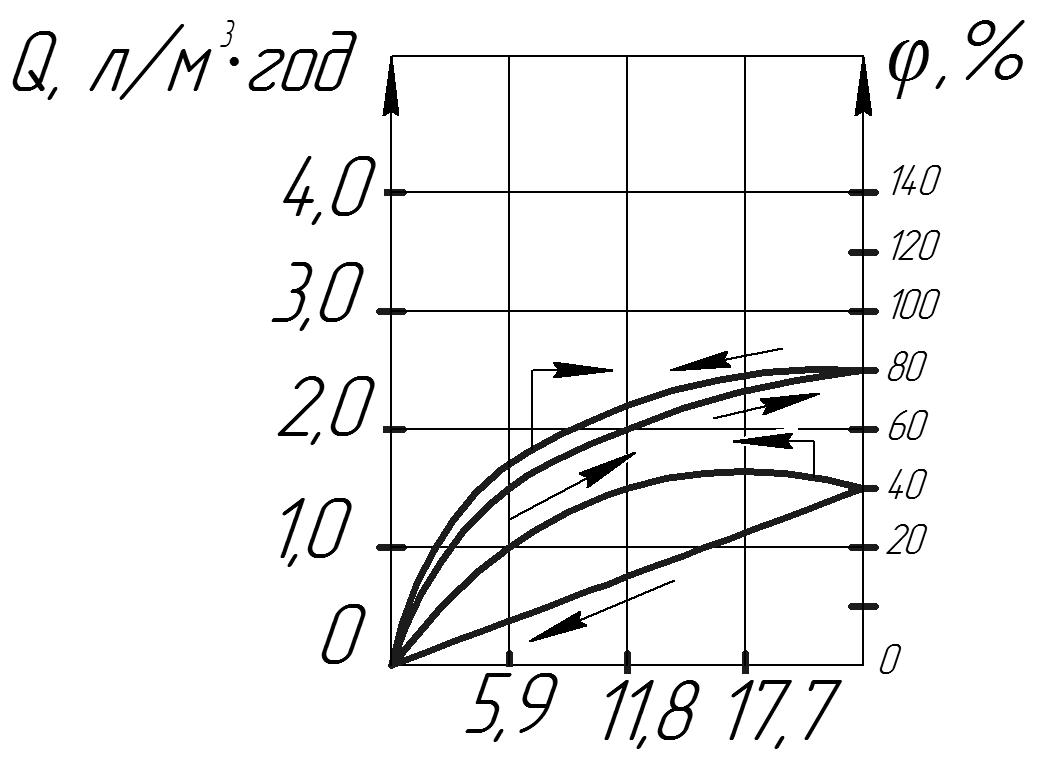
Рис.6
Такі властивості полімерів називають в’язкопластичними. Як критерій для характеристика в’язко-еластичних властивостей мембрани(строку її служби), можна прийняти площу вузла гістерезису, що описується кривою Q(p) при послідовному збільшенні р від 0 до певного значення, а потім зміну тиску у зворотній послідовності. У дійсності уповільнене але безперервне збільшення Q спостерігається протягом всього строку служби мембрани, який визначається саме цим показником, а не механічною міцністю мембрани. У мембран з більшою площею петлі гістерезису при неперервній роботі проникність знижується значно швидше і момент, коли експлуатація її через низьке значення Q стає недоцільною, наступає раніше. Для мембран з жорсткою структурою повинна бути характерна залежність проникності від рушійної сили процесу.
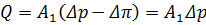
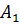 – константа проникності розчинника
– константа проникності розчинника
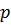 – робочий тиск
– робочий тиск
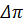 – осмотичний тиск.
– осмотичний тиск.
Селективність капілярно-пористих скляних мембран монотонно зростає із збільшенням рушійної сили процесу.
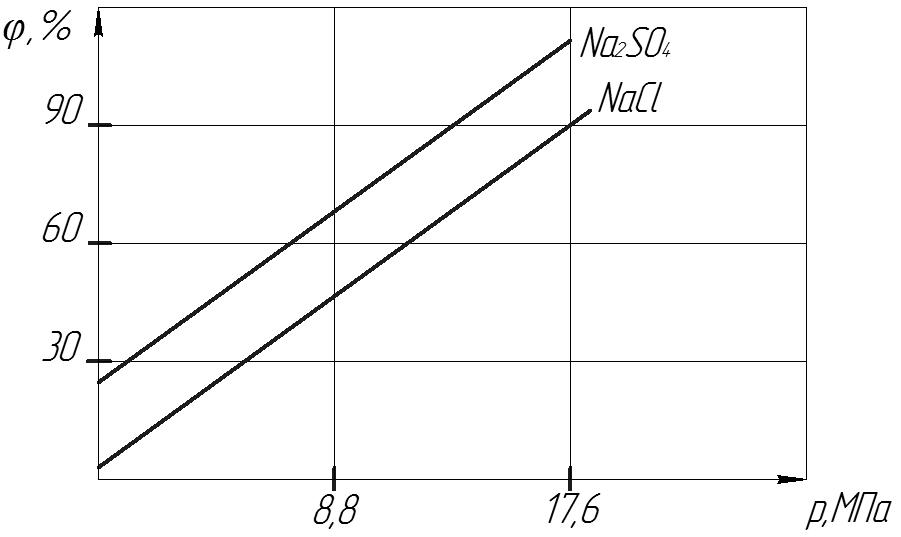
Рис. 7
При УФ можливі такі умови, коли у результаті великої проникності на поверхні мембрани із збільшенням тиску утворюється гель і як наслідок концентрація розчиненої речовини біля мембранної поверхні стає постійною і не залежить від робочого тиску, при цьому проникність мембрани ж практично постійною, що пояснюється зростанням опору протікання в результаті збільшення товщини гелю. Аналогічні залежності при мікрофільтрації.
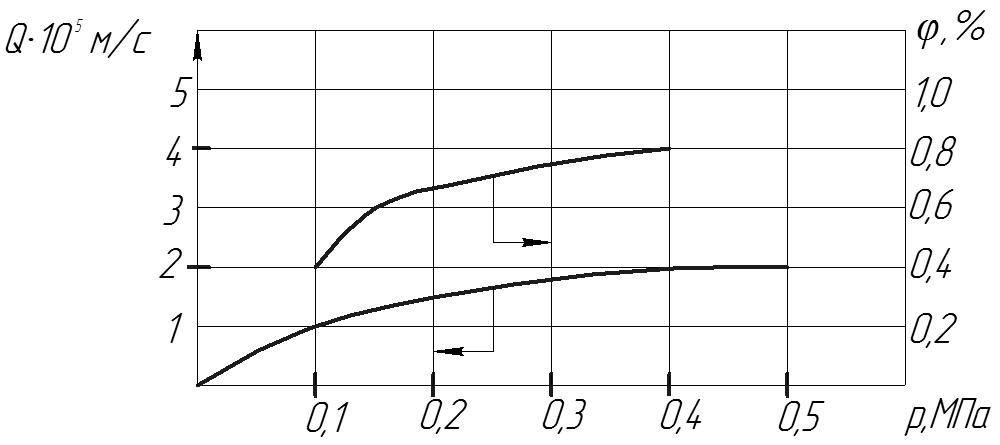
Рис. 8 Вплив робочого тиску на характеристики процесу УФ розчину пепсину.
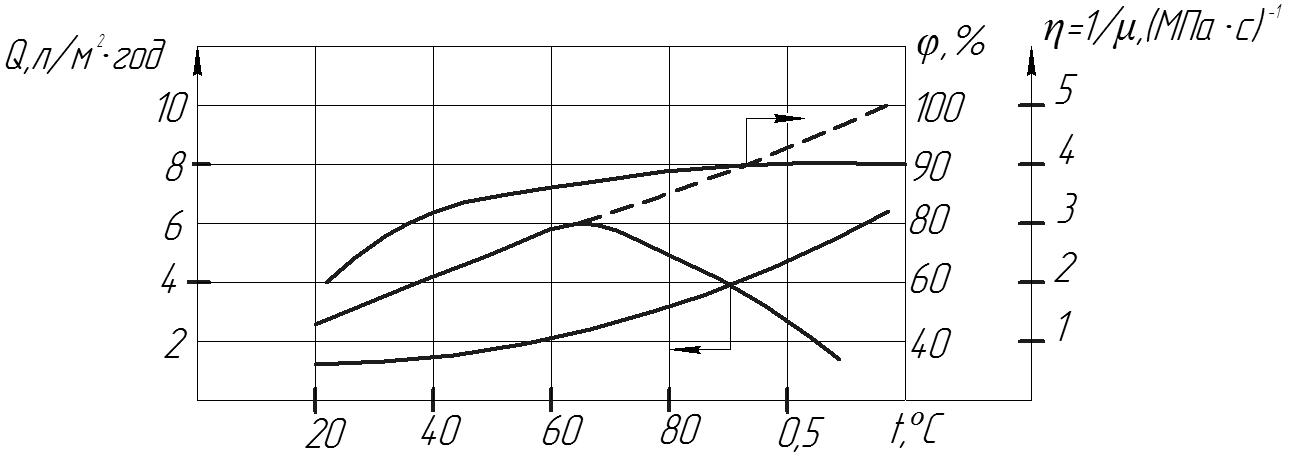
Рис.9 Залежність характеристик АЦ мембрани від температури і в’язкості однопроцентного розчину NaCl при тиску 12 МПа.
Температура
Відомо, що АЦ мембрани, які широко використовуються в процесах ЗО, руйнуються при порівняно невисокій температурі(60°С), тому найприйнятніша для них робоча температура – кімнатна. Як видно з рисунка 9, при температурі 95°С продуктивність мембрани зменшується практично до нуля, що можна пояснити осаджуванням і повним стягуванням її пор.
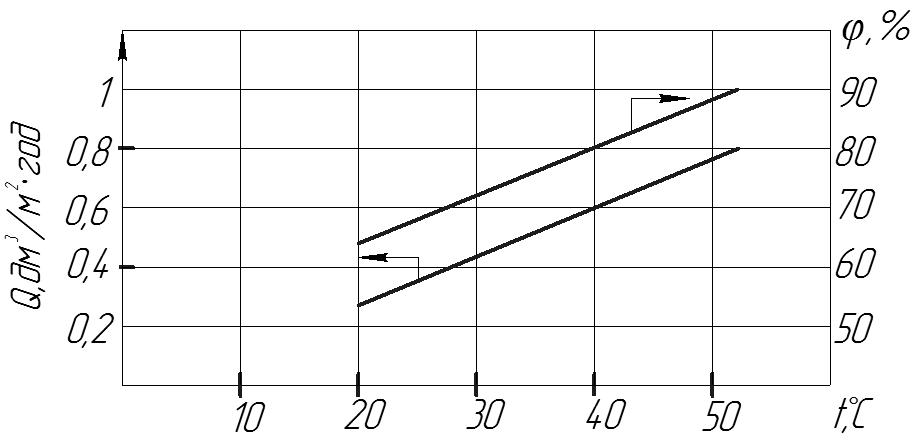
Рис.10. Вплив температури на характеристики капілярно-пористих скляних мембран, розчин NaCl з концентрацією 0,01 моль.
Концентрація розчинених речовин
Цей чинник є одним із основних, оскільки він означає не тільки характеристики процесів ЗО і УФ, а й саму можливість їх використання. Збільшення концентрації розчинених речовин призводить до підвищення осмотичного тиску, що зменшує рушійну силу процесу, а також призводить до зростання в’язкості.
 Все це викликає зниження проникності. Зі збільшенням концентрації зменшується товщина шару зв’язаної води на поверхні і в порах мембрани послаблюються сили взаємодії між іонами і молекулами води в розчинах неорганічних речовин, що призводить до зменшення селективності, у результаті додаткової дії концентраційної поляризації на мембрані при ЗО можуть випадати малорозчинні осади солей, а при УФ ВМС утворюють желеподібний шар, що порушує нормальну роботу апаратів, тому правильний вибір робочого інтервалу концентрацій є важливою умовою роботи установок ЗО і УФ.
Все це викликає зниження проникності. Зі збільшенням концентрації зменшується товщина шару зв’язаної води на поверхні і в порах мембрани послаблюються сили взаємодії між іонами і молекулами води в розчинах неорганічних речовин, що призводить до зменшення селективності, у результаті додаткової дії концентраційної поляризації на мембрані при ЗО можуть випадати малорозчинні осади солей, а при УФ ВМС утворюють желеподібний шар, що порушує нормальну роботу апаратів, тому правильний вибір робочого інтервалу концентрацій є важливою умовою роботи установок ЗО і УФ.
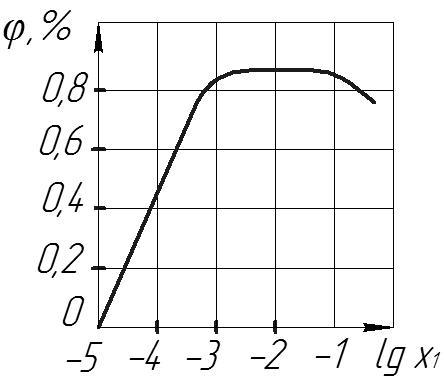
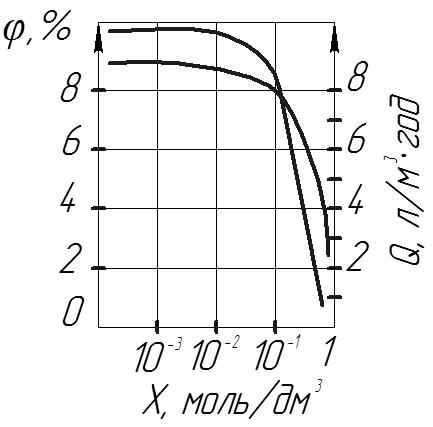
Рис.11 Рис.12
Як видно з вище наведених рисунків, селективність мембрани залежить від концентрації розчину електроліту. В процесі зворотного осмосу можна розділити на три області:
1) (10-5 – 10-3) моль/дм3 зростання селективності.
2) (10-3 – 10-1) моль/дм3 максимальна і незмінна селективність.
3) (10-3 – 10-1) моль/дм3 різке зменшення селективності.
В області 2 спостерігається максимальна селективність мембрани, а в області 3 її зменшення. Для повного вилучення солей із розбавлених розчинів
У цілому, аналіз експериментальних даних дає можливість зробити висновок, що ЗО доцільно використовувати при концентрації електролітів, вміст солей в яких не перевищує:
1-валентних 5%
2-валентних 10%
3-валентних 15%
Для органічних речовин цей інтервал набагато ширший.
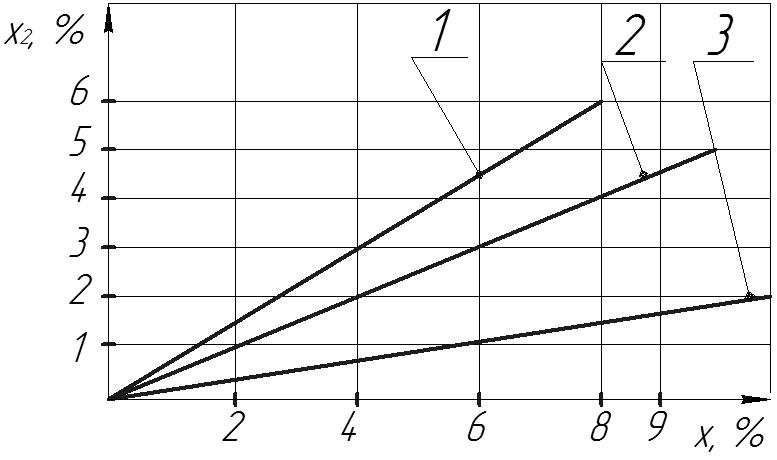
Вплив концентрації х, вихідного розчину на концентрацію х2 пермеату(АЦ мембрана) р= 10 МПа.
1 – ізопропанол;
2 – гліцерин;
3 – сахароза;
При УФ ВМ сполук, границя концентрацій визначається значенням при яких може початися випадання осаду або концентраціями для яких проникність стає низькою через надмірне зростання в’язкості розчину.
Експериментальний матеріал дозволяє формувати наступні принципи впливу природи розчинених речовин.
Неорганічні речовини затримуються мембранами краще ніж органічні з тією ж молекулярною масою. Речовини, які утворюють зв’язки з мембраною(водневий зв'язок) затримуються краще тим краще, чим менш міцний цей зв'язок.
| Система | Селективність | ||||
| Na+ | K+ | Ca2+ | Cl- | SO42- | |
| NaCl-H2O | 88,1 | ||||
| KCl-H2O | 87,2 | ||||
| CaCl2-H2O | 92,5 | 91,5 | |||
| KCl-NaCl-H2O | 87,5 | 86,0 | |||
| KCl-NaCl- CaCl2-H2O | 88,7 | 84,7 | 93,3 | 91,6 |
З таблиці видно, що розділення можливе для багатокомпонентних бівалентних розчинів.
Різниця концентрацій, як рушійна сила в мембранних процесах
У багатьох процесах транспорт речовин відбувається за рахунок дифузії, а не конвекції. Речовини спонтанно дифундують від місця з високим хімічним потенціалом до місця з меншим хімічним потенціалом.
До мембранних процесів для яких рушійною силою є різниця концентрацій відноситься ГЗР, ПВП, діаліз, а також процеси за участю різних мембран. Слід пам’ятати, що в ряді випадків(для неідеальних сумішей) правильніше говорити про різницю активностей а не концентрацій.
ГАЗОРОЗДІЛЕННЯ
Газорозділення можна здійснити з використанням пористих і непористих мембран.
ГЗР у пористих мембранах
Якщо транспорт газу здійснюється в’язким потоком як у випадку МФ мембран, то розділення не відбувається, оскільки середня довжина вільного пробігу молекул газу дуже мала в порівнянні з діаметром пор.
Молекули стикаються одна з одною, а не з стінками пор. Тобто наче не помічають мембрану. При зменшенні діаметру пор, довжина пробігу молекул газу може стати більшою за діаметр пор. Такий тип потоку газу називається «кнудсенівським потоком». Відомо, що середня довжина вільного пробігу може бути визначена як середній шлях, який долає молекула газу між стиканням.
У рідинах молекули знаходяться одна від одної на дуже близькій відстані, тому довжина вільного пробігу становить декілька ангстрем. Отже у рідин кнудсенівським потік можна не розглядати.
При зниженні тиску, середня довжина вільного пробігу збільшується. При постійному тиску ця величина пропорційна середній температурі: при 25 ºС середня довжина пробігу в О2 - 75 Ангстрем при 20 атм і 0,71 при 1 атм.
В УФ мембранах діаметр пор має інтервал від 20 нм до 0,2 мкн. Тобто кнудсенівська дифузія має суттєве значення.
ГЗР – за кнудсенівським механізмом залежить від співвідношення квадратних коренів їх молекулярних мас, а це означає, що за таких умов спостерігається низький ступінь розділення. Для його збільшення використовуються каскади модулів, що буває неекономічно.
На сьогодні цей спосіб використовується у промисловому масштабі лише для збагачення гексафториду урану, який є дуже дорогою речовиною.
Для ГЗР записується потік крізь мембрану 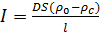 . Отже потік крізь мембрану пропорційний різниці парціальних тисків і зворотно-пропорційний товщині мембрани. Максимальна ефективність ГЗР досягається при великих значеннях відношення тисків. Рушійну силу процесу можна збільшити підвищуючи тиск на вході в мембрану або його знижуючи з боку пермеату.
. Отже потік крізь мембрану пропорційний різниці парціальних тисків і зворотно-пропорційний товщині мембрани. Максимальна ефективність ГЗР досягається при великих значеннях відношення тисків. Рушійну силу процесу можна збільшити підвищуючи тиск на вході в мембрану або його знижуючи з боку пермеату.
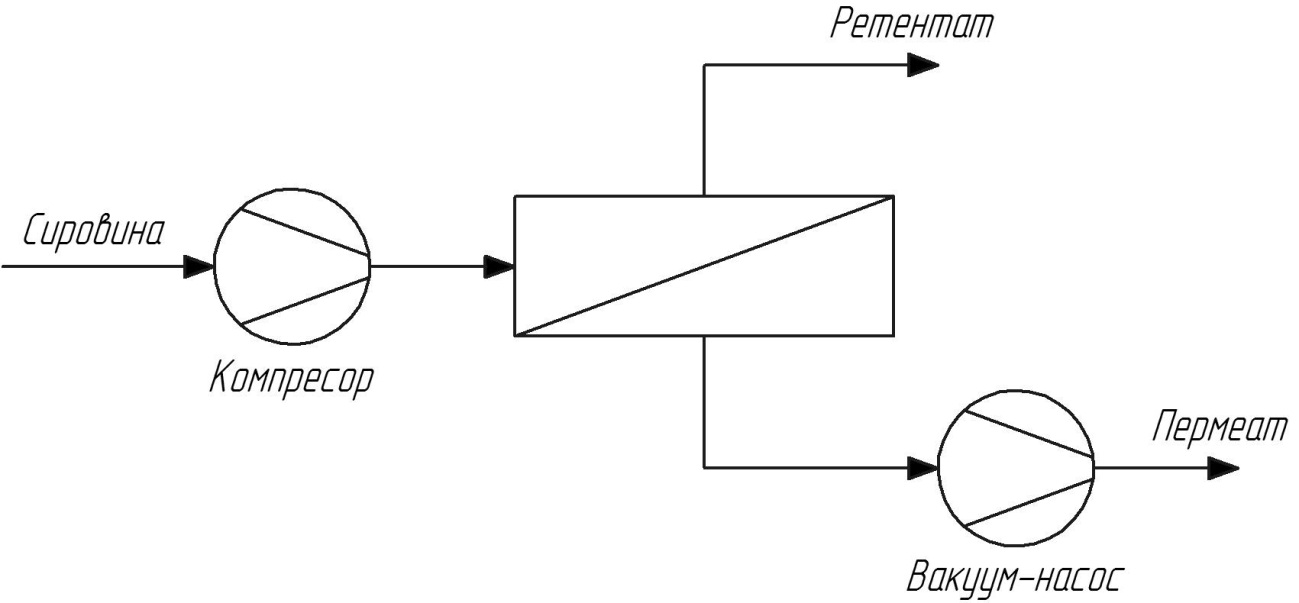
Рис.13. Схема процесу ГЗР
Для описання процесу ГЗР необхідно враховувати крім парціальних тисків й інші фактори, що пов’язані з властивостями полімеру: температура силування, кристалічність. Температура склування визначає в якому стані – склоподібному, чи високопластичному знаходиться полімер. Для аморфного полімеру у склоподібному стані сегментальна рухливість обмежена у той час як у високопластичному стані термічна енергія може призвести до обертання основного ланцюга. Температура склування визначається, головним чином, гнучкістю ланцюга та взаємодією ланцюга молекул.
ГЗР МЕМБРАНИ
Для ГЗР прийняті мембрани 2 типів: асиметричні і композиційні. Асиметричні мембрани, як правило отримують осадженням при зануренні(коагуляція полімеру із розчину при додаванні нерозчинника). Цей метод використовується для одержання основи композиційних мембран. На яку одним із наведених способів наносять тонкий селективний шар: нанесення при зануренні, міжфазна полімеризація, плазмова полімеризація. Тонкий верхній шар повинен бути абсолютно бездефектним, оскільки навіть мала кількість дефектів може змінити селективність мембрани без помітної зміни потоку. Певні вимоги існують і до пористих основ, а саме: забезпечити механічну підтримку верхнього шару, мати відкриті пори, що забезпечують мінімальний опір масопереносу, не мати макропустот, як місць, які перешкоджають використання мембран при високих тисках.
Використання ГЗР:
1. CO2/CH4. Задача розділення газів виникає у багатьох технологічних процесах: очистка метану, що утворився при переробці відходів у сховищах. Вилучення метану із природних газів, а також виділення CO2 у процесах збільшення нафтовіддачі.
2. Н2/Не у суміші з іншими газами.
Зазначені гази мають відносно малі розміри молекул і проявляють високі фактори розділення у випадку склоподібних полімерів. Розділення використовують при вилученні H2 із відхідних газів синтезу аміаку, нафтопереробних установок і синтезу метанолу.
3. H2S/CH4. Окрім CO2 природний газ може мати значну кількість H2S. Цей газ надзвичайно токсичний, викликає корозію обладнання і тому його концентрація повинна бути знижена до менше 2%.
4. О2/N2. При розділенні повітря доцільним є одержання збагаченого киснем пермеату і ретентату зі збільшеною концентрацією азоту. Збагачене азотом повітря 95-99,9% використовується як інертний газ для зберігання палива у резервуарах.
5. Усі випадки сушки газів.
6. Вилучення SO2 з димових газів.
ПЕРВАПОРАЦІЯ(ПВП)
ПВП – це процес в якому рідина при атмосферному тиску контактує з вхідною поверхнею мембрани, а на протилежному боці мембрани, пермеату вилучається у вигляді пари з низьким парціальним тиском. Низького парціальний тиск пари досягають використанням газоносія або вакуум-насоса.
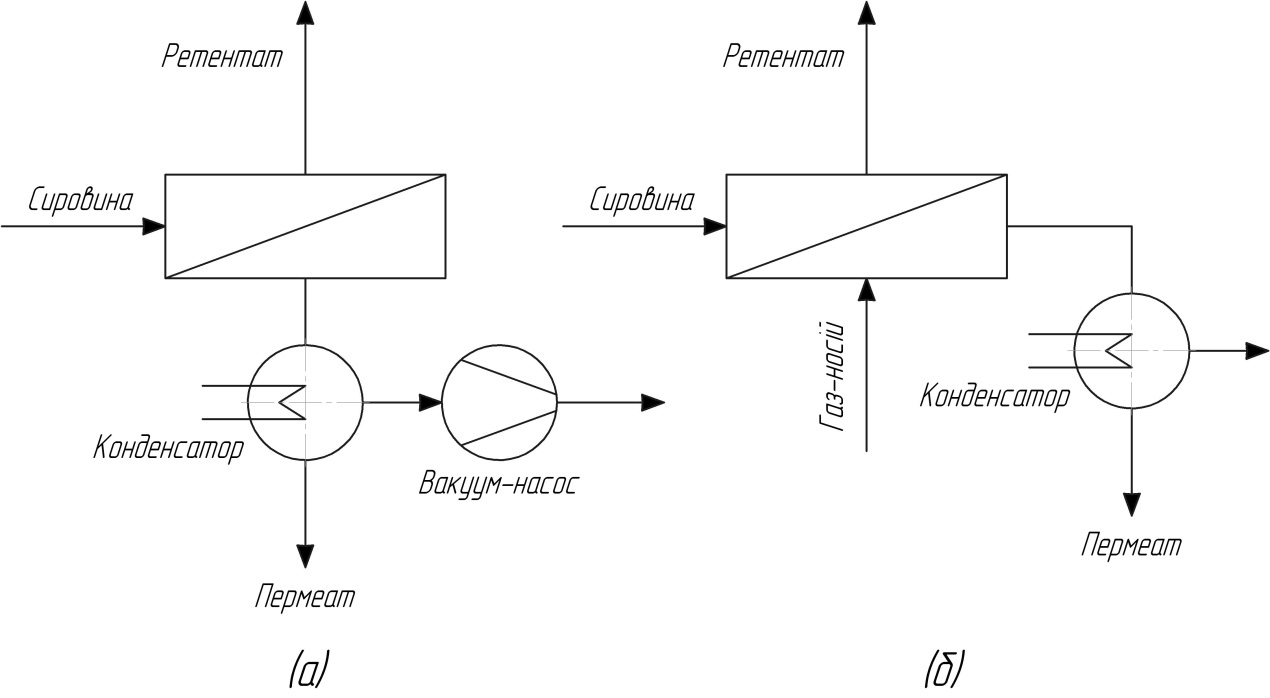
Рис.14. схема процесу ПВП при (а) – вакуумуванні після мембрани; (б) – продувці інертним газом.
Суттєво, що процес включає в себе 3 основні стадії:
1. Селективна сорбція на вхідній поверхні мембрани.
2. Селективна дифузія крізь мембрану.
3. Десорбція в пароподібну фазу на вихідній поверхні.
Мембрана діє як бар’єр ріж двома фазами. Мається на увазі, що необхідно підводити тепло по крайній мірі для випарювання. Різниця між дистиляцією і ПВП полягає у тому, що дистиляція ґрунтується на рівновазі «пар-рідина», а ПВП на різниці коефіцієнтів розчинності та дифузії. Транспорт при ПВП можна описати за допомогою механізму розчинення – дифузії в якому селективність визначається сорбцією і/чи селективною дифузією. Для суміші компонентів ij проникність по і -му компоненту можна виразити у вигляді функції:
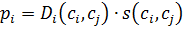
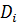 – коефіцієнт дифузії;
– коефіцієнт дифузії;
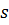 – коефіцієнт розчинності.
– коефіцієнт розчинності.
ПВП МЕМБРАНИ
Для ПВП, як і для ГЗР необхідні непористі мембрани переважно з анізотропною морфологією, асиметрична структура яких складається з верхнього щільного шару, що нанесений на основу з відкритими порами. Вимоги до мікроструктури ПВП мембран такі ж як і до мембран для ГЗР:
1. Відкрита пористість основи для мінімізації опору транспорту ари і попередження капілярної конденсації.
2. Висока поверхнева пористість опори з вузьким розподіленням пор за розмірами. Якщо пори основи дуже малі, це може призвести до капілярної конденсації пари. При великих порах основи утруднюється безпосереднє нанесення на неї тонкого селективного шару. Методи нанесення тонкого шару на основу ПВП мембран такі ж як і для ГЗР мембран: нанесення при зануренні, міжфазна і плазмова полімеризації. Можна зробити певні зауваження відносно вибору полімеру. Так, наприклад, мембрани не повинні сильно набухати, щоб уникнути різкого зниження селективності. У той же час низька сорбція, як і недостатнє набухання призводять до дуже малих потоків. Оптимальні властивості знаходяться десь посередині і за грубою оцінкою значення загальної сорбції, що дорівнює 5-25% є прийнятним.
ВИКОРИСТАННЯ ПВП:
ПВП є складним процесом у якому характеристики розділення сильно залежать від складу суміші. Цей процес використовується в основному для відділення малих кількостей одного із компонентів рідкої суміші такий спосіб розділення особливо перспективний для розділення азіотропів. Такі суміші не розділяються звичайною дистиляцією. У зв’язку з тим, що число можливих використань ПВП дуже велике, корисно зробити їх класифікацію на водні і неводні суміші:
Водні суміші:
- дегідратація – вилучення води із спирту та інших органічних розчинників(вилучаються навіть сліди).
- очищення води від органічних речовин – вилучення спирту із ферментаційного середовища. Вилучення летких органічних вуглеводнів із стічних вод.
Неводні суміші:
- полярна/неполярна рідини – спирти/ароматичні сполуки(метанол/толуол;спирти), аліфатичні сполуки(етанол/гексан).
- Суміші ароматичні/аліфатичні рідини – циклогексан/бензол;гексан/толуол.
- Суміші насичених і ненасичених вуглеводнів (бутан/бутен).
МЕМБРАННА ДИСТИЛЯЦІЯ
Процес МФ відбувається у системі в якій 2 рідини чи 2 розчини, що розділені мембраною підтримуються при різних температурах. Рідини чи розчини не повинні змочувати стінки пор мембрани, у противному випадку за рахунок капілярних сил, пори миттєво заповнюються рідиною. Таким чином у випадку водних розчинів необхідно використовувати незмочувані пористі гідрофобні мембрани.
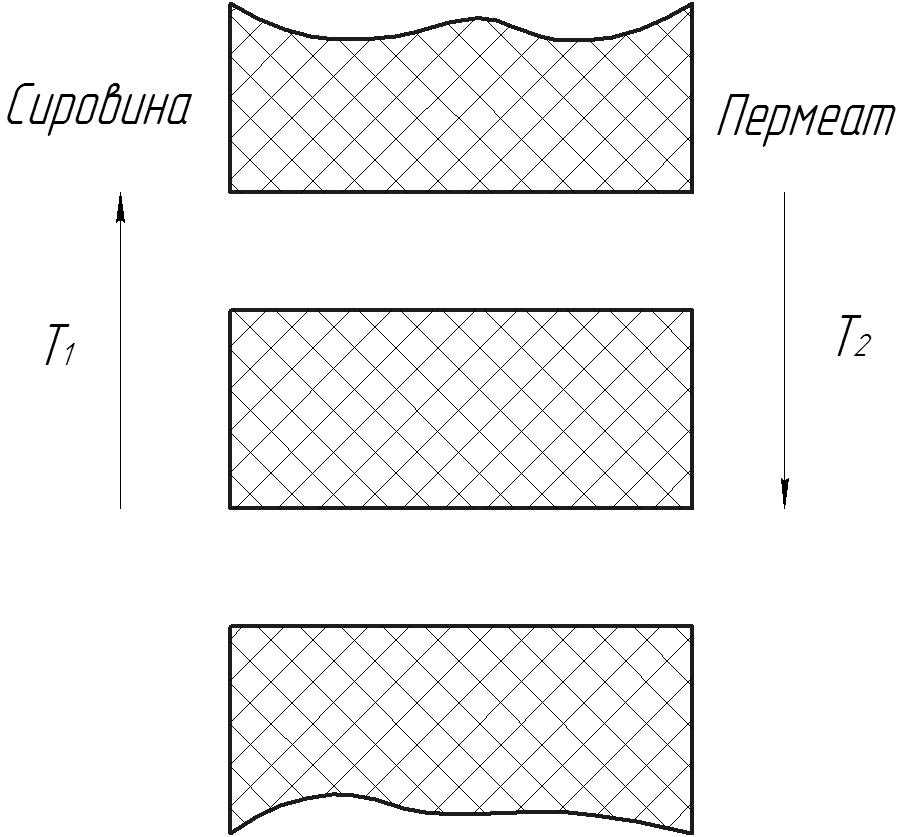
Рис.15
Якщо обидві рідкі фази представлені чистою водою, то у відсутності різниці температур система знаходиться у рівновазі і транспорт у ній відсутній. При збільшенні температури однієї із фаз на мембрані виникає градієнт температури, що призводить до різного тиску парів з обох боків мембрани, так що пароподібні молекули будуть проноситись через пори з боку більшого тиску парів в бік з меншим тиском парів. Транспорт, який виникає, відбувається в 3 стадії:
1. Випаровування на стороні мембрани з більшою температурою.
2. Перенесення пароподібних молекул крізь пори гідрофобної пористої мембрани.
3. Конденсація нас стороні мембрани з меншою температурою.
МД є єдиним мембранним методом в якому мембрана безпосередньо в акті розділення участі не бере і її функція зводиться до ролі бар’єру між двома фазами. У випадку сольових розчинів, наприклад NaCl у H2O, створюється тільки тиск пари води, оскільки тиском пари NaCl можна знехтувати. І тільки вода буде проникати крізь мембрану, причому з дуже високою селективністю. Перенесення летких компонентів крізь мембрану за умов МД може бути описане феноменологічними рівняннями в яких потік пропорційний рушійній силі, тобто різниці температур з обох боків мембрани.
 – коефіцієнт пропорційності, що характеризує властивості мембрани.
– коефіцієнт пропорційності, що характеризує властивості мембрани.
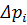 – параметр, який характеризує умови проведення процесу.
– параметр, який характеризує умови проведення процесу.
Коефіцієнт В залежить від таких властивостей мембрани:
1. Природа матеріалу(ступінь гідрофільності чи гідрофобності).
2. Структура пор.
3. Пористість, яка повинна бути, по можливості, високою.
4. Товщина мембрани.
5. Розподіл пор за розмірами(повинне бути вузьким). Великі пори змочуються в першу чергу.
Параметр 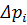 залежить тільки від різниці температур.
залежить тільки від різниці температур.
Не менш важливими параметрами є гідродинамічні умови(швидкість потоку) і конструкції апаратів, оскільки від них залежить температурна поляризація системи, а отже і величина рушійної сили.
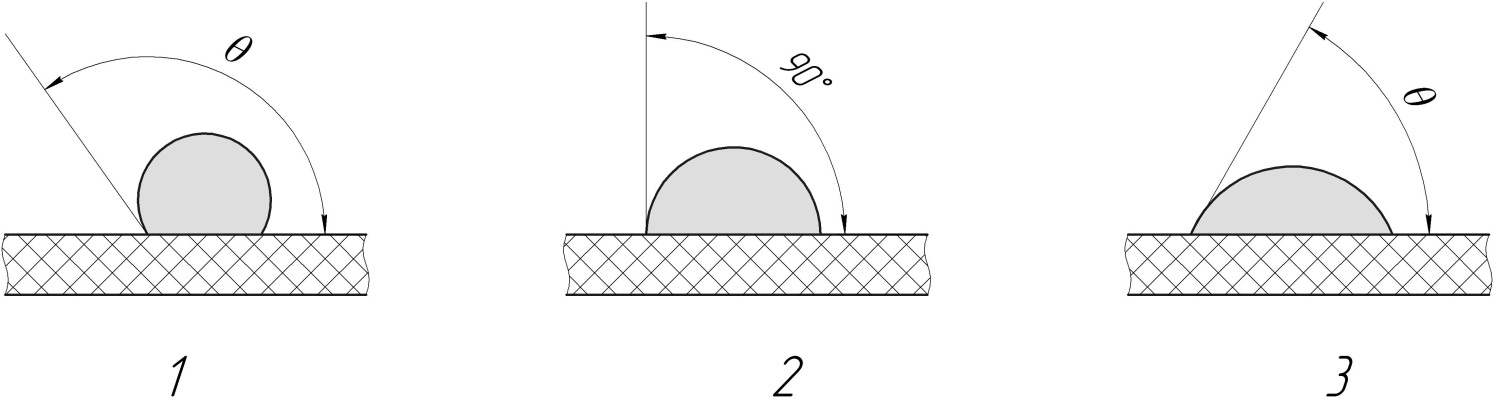
Рис.16. Кути контакту рідкої краплі на поверхні пористого полімеру
Обов’язковою властивістю дистиляційної мембрани повинна бути її незмочуваність рідкою фазою, оскільки при змочуванні, рідина спонтанно заповнює пори мембрани. Змочуваність визначається взаємодією між рідкою фазою і полімером. Причому незмочуваність спостерігається при низькій взаємодії між фазами. Оцінити змочуваність можна вимірюванням контактних кутів у трифазному контакті: краплю рідини розміщують у газовому середовищі на непористу пласку і гладку полімерну поверхню і вимірюють її контактний кут, при малій спорідненості контактний кут θ буде більший за 90°.
При змочуванні контактний кут <90°. Рідина просочує пори пористого матеріалу, це явище описується рівнянням Лапласа.
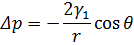
Як видно з наведеного рівняння, змочування залежить від 3-х факторів:
1. Розміру пор(радіус 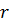 ).
).
2. Поверхневого натягу рідини(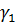 ).
).
3. Поверхневої енергії мембранного матеріалу( ).
).
Змочування зворотно-пропорційне розміру пор мембрани.
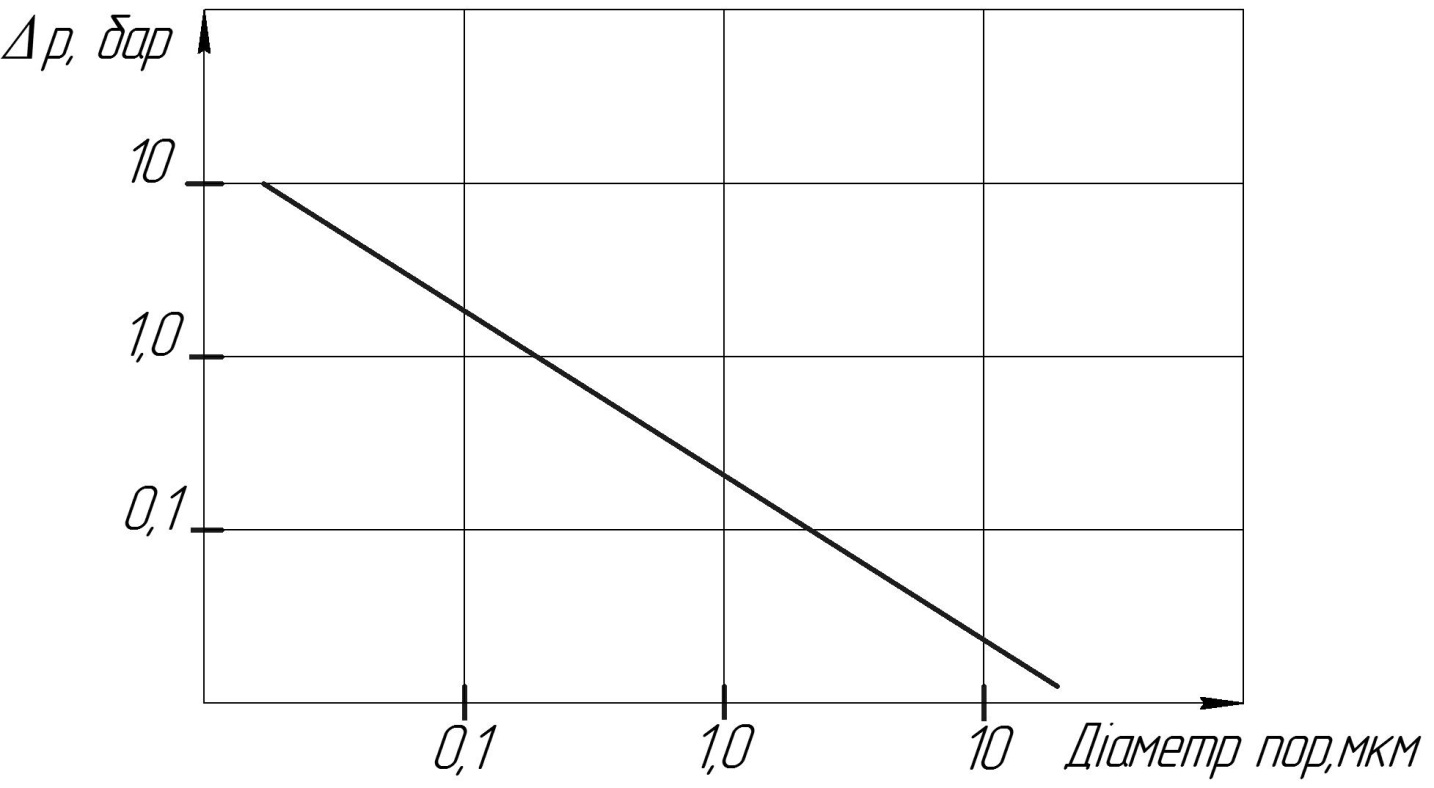
Рис.17. Тиск змочування пористої мембрани на основі політетрафторетилену.
На рисунку показано, який тиск необхідно прикласти до пористої тефлонової мембрани, щоб рідина змочувала пори мембрани в залежності від розміру пор.
Другим параметром є поверхневий натяг рідини. Цей параметр визначається міжмолекулярними взаємодіями такими як дисперсні сили взаємодії диполів і водневі зв’язки. У вуглеводнів(гексан наприклад) діють тільки слабкі дисперсні сили, тому поверхневий натяг малий, а при утворенні водневих зв’язків, наприклад у воді, міжмолекулярні сили дуже великі і, відповідно, поверхневий натяг теж.
Третім важливим фактором є поверхнева енергія полімеру, Оскільки змочуються, як правило, тільки високоенергетичні полімери(гідрофільні). До не змочуваних матеріалів відносяться гідрофобні.
МЕМБРАНИ ДЛЯ МД
Вимоги до мембран, які використовуються для МД очевидні. Щоб уникнути змочування необхідно використовувати тонкопористі мембрани, рідини з високим поверхневим натягом(вода) і полімерний гідрофобний матеріали з низькою поверхневою енергією(поліпропілен, тефлон). Оптимізувати мембрани навряд чи є можливим, оскільки селективність визначається рівновагою рідина-газ. Що стосується потоку, то він піддається оптимізації завдяки пористості. Збільшення пористості супроводжується підвищенням розміру пор, що в свою чергу сприяє змочуванню. Бажано, щоб висока пористість(70-80%) дистиляційної мембрани поєднувалась з розміром пор 0,2-0,3 мкн.
ВИКОРИСТАННЯ МД
Використання може бути двох типів:1) Продуктом процесу є пермеату. 2)Цільовий продукт – ретентат.
При пермеаті: 1. Виробництво ультра чистої води. Воду використовують для напівпровідникової промисловості. 2. Бойлерна вода для енергоустановок. 3. Опріснення морської води.
При МД якість пермеату залишається високою навіть при дуже високих концентраціях на вході в мембрану.
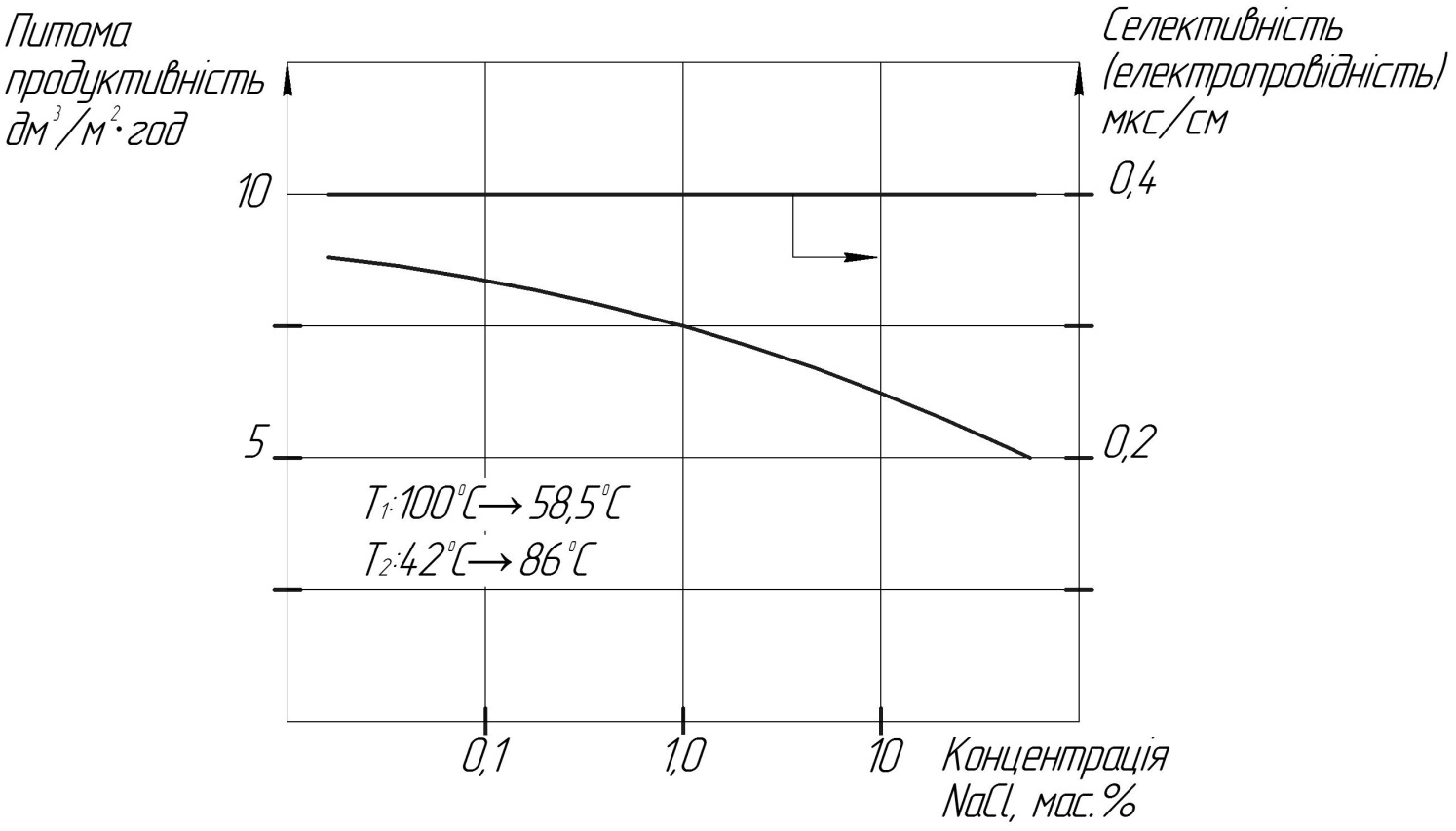
Рис.18
На рисунку показано потік і селективність пористої поліпропіленової мембрани в залежності від концентрації солі NaCl.
При знесоленні морської води ЗО процес сильно залежить від осмотичного тиску висококонцентрованих розчинів, які подаються на мембрану, у той час при МД використовуються і концентрованіші розчини без помітного зниження ефективності мембрани.
При ретентаті: при обробці стічних вод, концентруванні солей, кислот, лугів тощо.
ЕЛЕКТРОМЕМБРАННІ ПРОЦЕСИ
ЕЛЕКТРОДІАЛІЗ
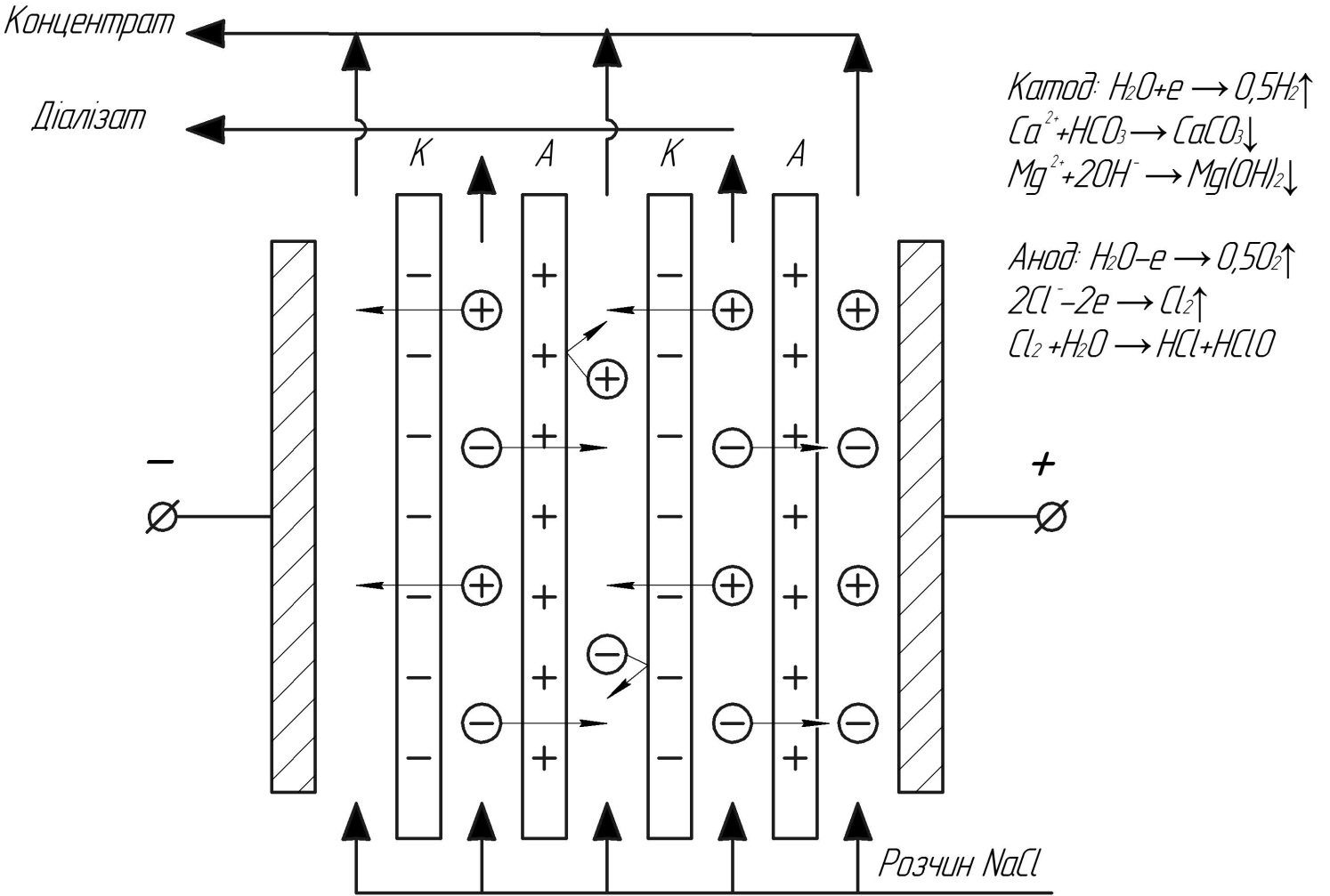
Рис.19. Схема процесу ЕД
Це метод вилучення іонізованих речовин із рідин завдяки мембранам, які вибірково проникні до катіонів чи аніонів. Мембрани, що проникні для катіонів отримали назву кат іонообмінних чи катіонітових. Вибірково проникні для аніонів – аніонообмінних чи аніонітових. Неодмінною умовою за якої може відбуватися процес електродіалізу є чергування катіонітових та аніонітових мембран і накладання на всю систему поля постійного струму. Відоме використання для ЕД і змінного струму, однак у цьому випадку мембрани чи електродні камери є пристроями, що випрямляють змінний струм. При прокачуванні розчину електроліту, наприклад NaCl, крізь камери електродіалізатора, в них не буде відбуватися розділення до тих пір, поки не буде прикладений постійний електричний струм.
При накладанні різниці потенціалів позитивно заряджені іони Na+ рухаються до катоду, а негативно заряджені аніони Cl- до аноду. Причому Cl- не можуть проходити крізь негативно заряджену мембрану, а катіони крізь позитивно заряджену. Це означає, що загальний результат процесу полягає у збільшенні концентрації іонів в одних камерах і зменшенні в інших камерах.
Принцип процесу ЕД:
А – аніонітові мембрана
К – катіонітова мембрана
На електродах відбувається електроліз, причому на негативно зарядженому катоді виділяється Н2 і ОН-, а на позитивно зарядженому аноді Cl2, O2 і H+.
Водень, що виділяється на катоді звичайно викидається в атмосферу. Вентиляція приміщення в якому працюють електродіалізатори не повинна забезпечувати вибухонебезпечну концентрацію водню.
ПАРАМЕТРИ ПРОЦЕСУ ЕД
Кількість іонів, які переносяться крізь іонітові мембрану прямо пропорційна силі електричного струму І чи густині струму. Головним недоліком ЕД є концентраційна поляризація, що обмежує густину струму. Електричний струм
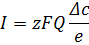
I – електричний струм;
z – валентність іону;
F – постійна Фарадея;
Q – швидкість потоку;
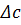 – різниця концентрацій до і після мембрани;
– різниця концентрацій до і після мембрани;
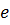 - ефективність мембрани.
- ефективність мембрани.
Остання величина зв’язана з долею загального струму затраченого на перенесення іонів. Теоретично кількість струму, що дорівнює одному Фарадею здатна перенести 1 г еквіваленту-аніонів до аноду(35,5 г Cl-) і 1 г еквівалент-іонів до катоду(23 г Na+). На цей параметр впливає проникність мембрани по воді(внаслідок осмосу вода дифундує з розбавлених розчинів у концентрованіші), а також той факт, що мембрани не зовсім селективні.
Електричний струм І зв’язаний з електричною напругою за законом Ома:
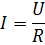
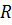 – загальний опір мембранного блоку, що дорівнює опору парної камери
– загальний опір мембранного блоку, що дорівнює опору парної камери 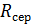 помноженому на число таких камер в ЕД.
помноженому на число таких камер в ЕД.
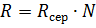
В свою чергу виражає собою суму 4-х опорів:
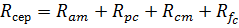
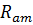 – опір аніонообмінної мембрани;
– опір аніонообмінної мембрани;
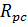 – опір камери концентрування;
– опір камери концентрування;
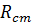 – опір катіонообмінної мембрани;
– опір катіонообмінної мембрани;
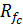 – опір камери знесолення.
– опір камери знесолення.
Різниця напруги, що повинна бути прикладена для здійснення процесу електродіалізу визначається загальним опором мембранного блоку і густиною струму. Збільшення останньої викликає зростання кількості перенесених іонів, проте щільність струму не можна збільшувати безмежно, гранична густина струму – це той струм, який переносить усі іони. При недоцільному збільшенні густини струму відбувається дисоціація води.
Граничне значення густини струму для розчину(Na+1:1Cl-), величина Ilim визначається за законом Нернста:
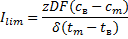
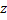 – заряд проти іонів;
– заряд проти іонів;
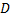 – коефіцієнт дифузії протиіонів;
– коефіцієнт дифузії протиіонів;
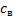 – концентрація електроліту в глибині розчину;
– концентрація електроліту в глибині розчину;
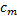 - концентрація електроліту біля поверхні мембрани;
- концентрація електроліту біля поверхні мембрани;
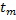 – число переносу іонів в мембрані;
– число переносу іонів в мембрані;
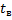 - число переносу іонів в розчині;
- число переносу іонів в розчині;
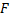 – число Фарадея;
– число Фарадея;
 – товщина шару біля мембрани.
– товщина шару біля мембрани.
Оскільки коефіцієнт масо перенесення 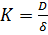 , величина
, величина 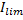 сильно залежить від гідродинамічних особливостей системи: швидкість потоку перпендикулярного транспорту іонів, геометрії відповідних каналів потоку.
сильно залежить від гідродинамічних особливостей системи: швидкість потоку перпендикулярного транспорту іонів, геометрії відповідних каналів потоку.
ІОНІТОВІ МЕМБРАНИ
Найважливішою частинною електродіалізаторів є іонітові мембрани на основі синтетичних іонітових смол. Останні являють собою високомолекулярні органічні сполуки, макроланцюги яких просторово зв’язані між собою, утворюючи так звану матрицю іоніту. Силами хімічної взаємодії з матрицею зв’язані електрично заряджені групи атомів, які мають назву фіксовані іони. Заряд фіксованих іонів компенсується протилежно зарядженими проти іонами. При контакті з водою іоніт набухає і відбувається дисоціація фіксованої пари «іон-протиіон». Оскільки концентрація фіксованих іонів у звичайних іонітах висока(2-3 М), то при контакті з розбавленими розчинами(0,1 М) іони, що однойменно заряджені фіксованими лише в незначній частині проникають в іоніт. Тому практично єдиним носієм струму в смолах є проти іон. В катіонітових мембранах, як фіксовані іони найчастіше виступають сульфогрупи 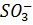 в аніонітових вторинні, третинні, четвертинні аміногрупи аліфатичного ряду, а також піридинові групи. За приклад наведемо будову декількох іонітних смол, що використовуються для виготовлення іонітових мембран.
в аніонітових вторинні, третинні, четвертинні аміногрупи аліфатичного ряду, а також піридинові групи. За приклад наведемо будову декількох іонітних смол, що використовуються для виготовлення іонітових мембран.
1. КУ-2– продукт сульфування співполімеру стиролу та дивінілбензолу.
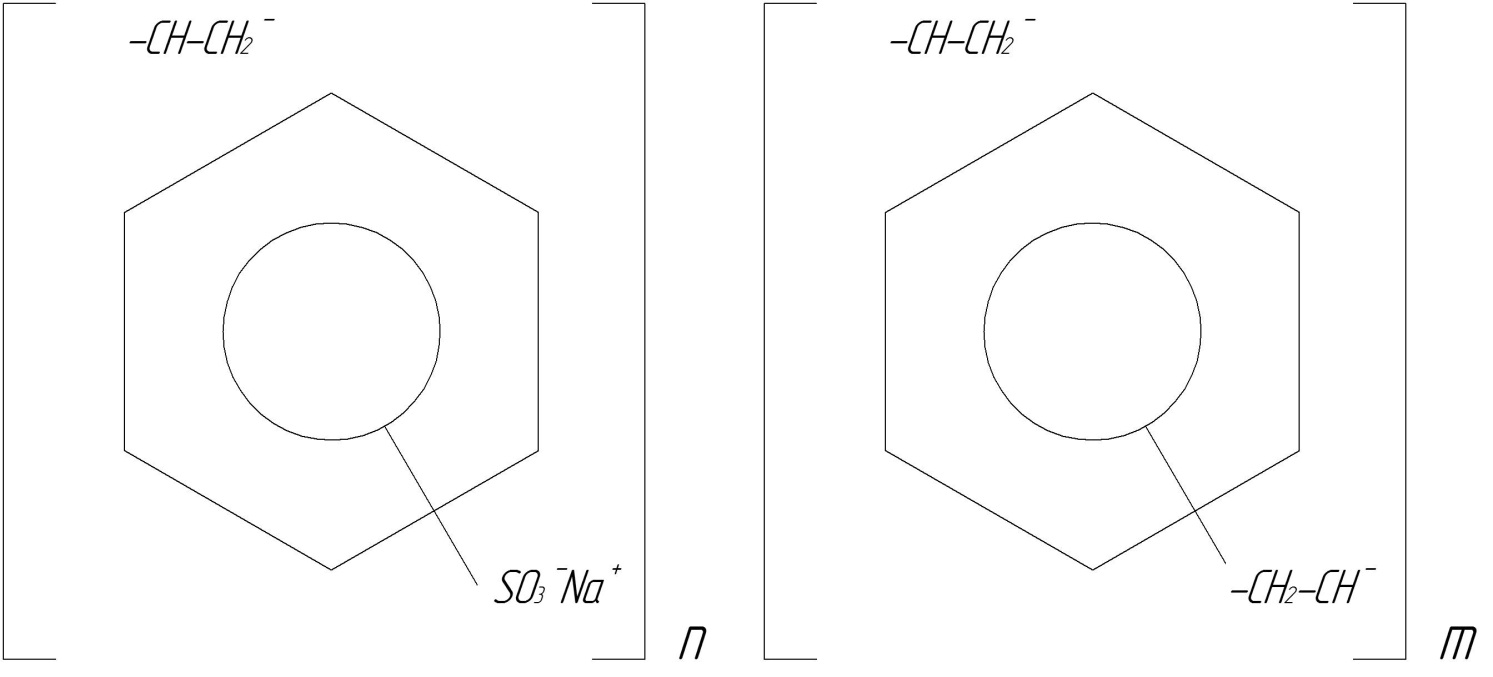
Рис.20
2. Аніоніт АВ-17
Отримують хлорметилуванням співполімеру стиролу і дивінілбензолу наступним амінуванням триметиламіном.
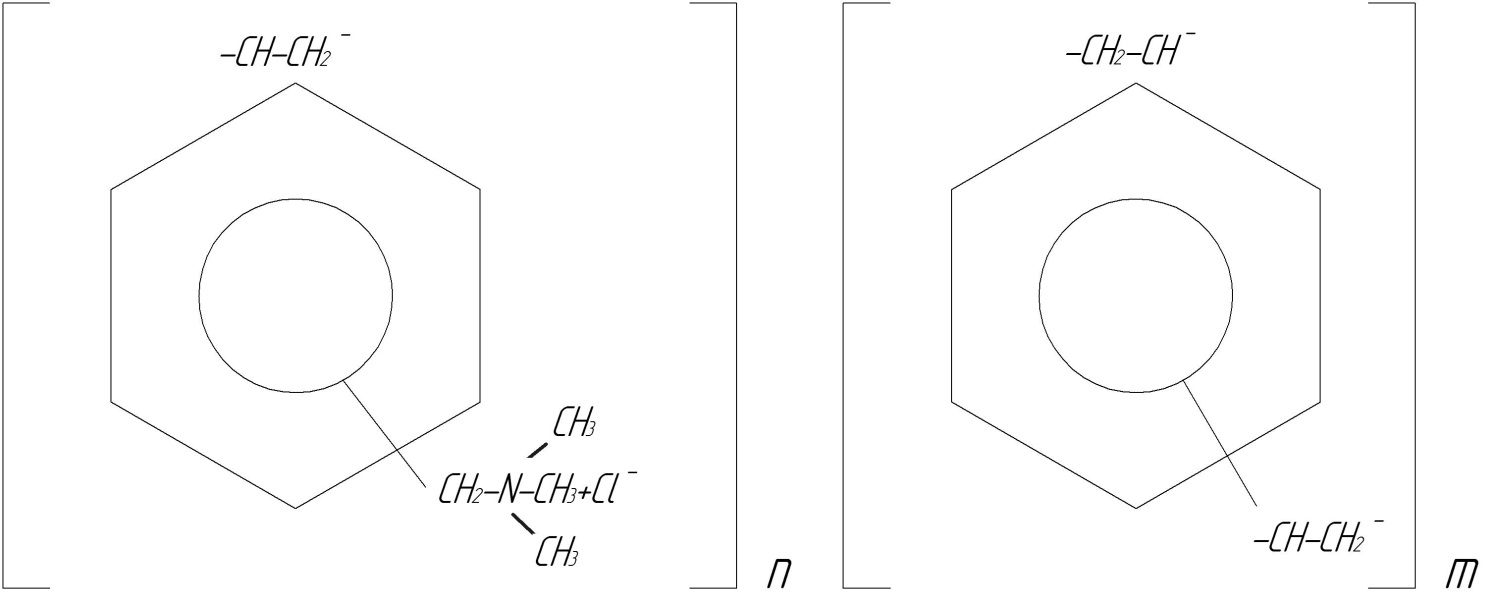
Рис.21
Отже у результаті співполімеризації стиролу і дивінілбензолу утворюється зшитий співполімер в який можна ввести катіоно- чи аніонообмінні групи.
Існують два різновиди іонітових мембран: гомогенні і гетерогенні.
Порошкоподібний іоніт змішують з поліетиленом в гарячих вальцях або екструдерах. Потім одержану масу прокочують і армують. Електричний опір таких мембран відносно високий, а механічна стійкість відносно мала, особливо при високих степенях набухання.
Гомогенні мембрани виготовляють шляхом введення іонних груп у полімерну плівку за таких умов: заряд розподілений рівномірно по всьому об’єму мембрани. Щоб не було великого набухання мембрани, полімерні плівки повинні бути зшитими. Хімічна стійкість іонітових мембран достатньо висока і вони можуть використовуватися в діапазоні рН від 1 до 14.
До іонітових мембран пред’являють 2 вимоги – висока електропровідність і висока проникність для іонів. Електропровідність можна збільшити підвищенням концентрації заряджених груп. Однак при цьому полі електроліт може виявити високу схильність до набухання. У зв’язку з цим такі матеріали повинні бути зшитими, причому сорбція іонів визначається як ступенем зшивання так і густиною заряду. Отже, залежно від матеріалу мембрани коефіцієнт дифузії іонів у мембрані можуть змінюватись від 10-6 см2/сек і до
Основні параметри якісних електродіаліз них мембран наступні:
- Висока селективність;
- Висока електропровідність;
- Помірний ступінь набухання;
- Висока механічна міцність;
Електричний опір на одиницю поверхню іонітових мембран зазвичай складає 20 Ом/см2, а густина заряду 1-2 мгекв/г.
ЕЛЕКТРОДИ
В ЕД, які працюють без реверсу струму катоди виготовляють з нержавіючої сталі. При реверсуванні струму, як матеріал електродів використовують графіт чи платинований титан.
За матеріал аноду використовують графіт, платинований титан чи метало оксидні електроди(Ti/MnO2 i Ti/RuO).
Конструктивно найдоцільніше використовувати електроди з платинованого титану, вони займають мало місця, достатньо стійкі(витрати платини 1-2 мг на тону перенесеної солі, або 2% в рік) при товщині покриття 1-3 мкм, до них зручно підводити струм. Основним недоліком таких електродів є висока вартість порівняно з іншими матеріалами
Найдешевшими і найдоступнішими є графітові електроди. До їх переваг такої слід віднести меншу схильність до обростання осадом карбонату кальцію і гідроксиду магнію, це пов’язано з тим, що осади, які утворюються на катоді і не розчиняються при реверсі струму частково осипаються разом з викришуваними частками графітую
Металооксидні електроди за своїми характеристиками не поступаються електродам з платинованого титану, проте вони мають менший строк служби, не допускають реверсування струму. Вартість електродів на основі RuO2 і електродів з платинованого титану дуже висока.
ВИКОРИСТАННЯ ЕЛЕКТРОДІАЛІЗУ
В середині 20 століття ЕД використовували для очистки води.
Запропоновано використання ЕД для комплексної переробки шахтних вод з метою їх знесолення до норм на зрошення і отримання розсолів, що забезпечують їх подальшу переробку на окремі солі.
За цих умов вода надходить в камери концентрування тільки з гідратованими іонами крізь іонітові мембрани під дією поля ПЕС.
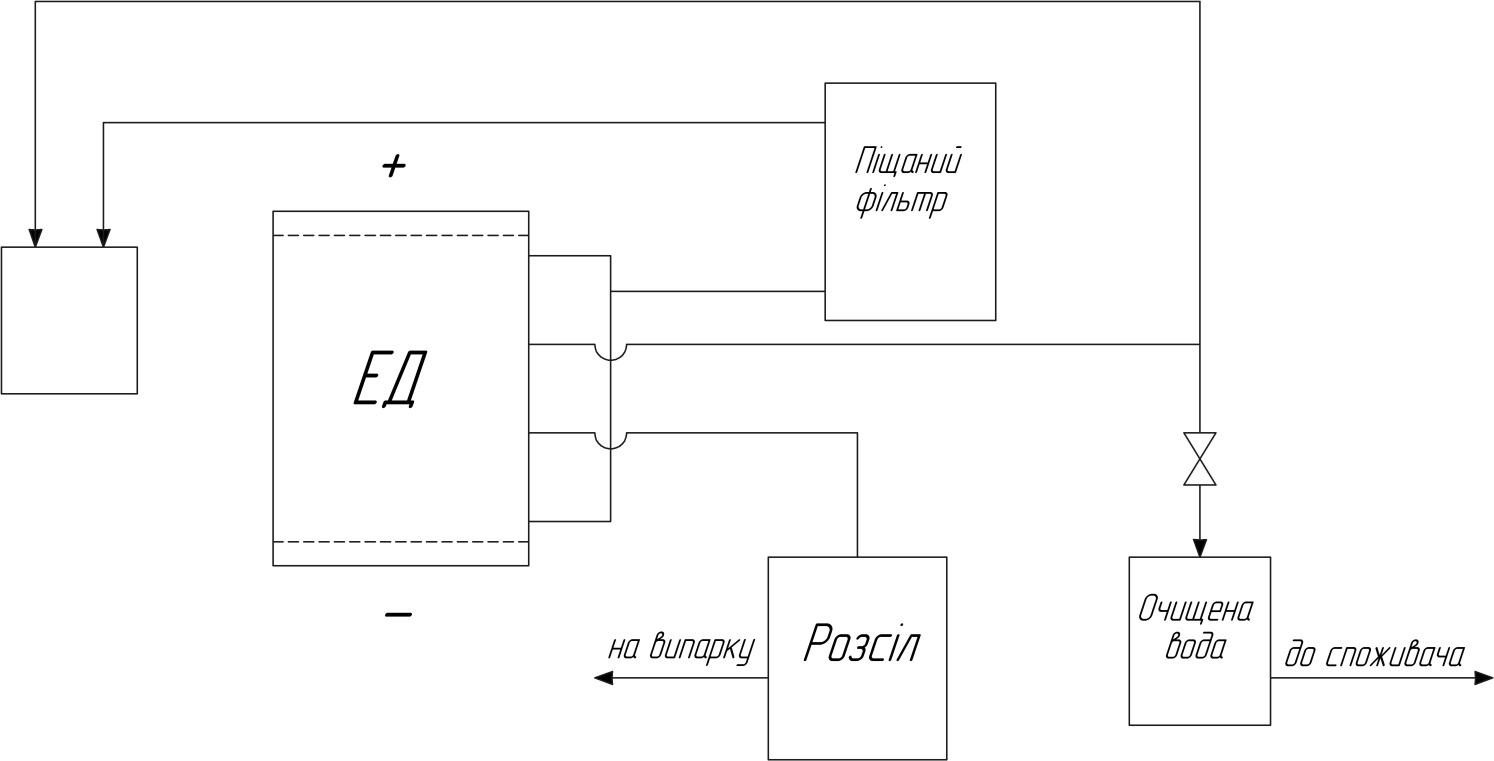
Рис.21. Принципова схема знесолення мінералізованих шахтних вод і глибокого концентрування розсолу.
При заданій напрузі на ЕД – 200 В і швидкості потоку імітату шахтної води – 1 м3/с, tв=25°С, вмісті хлориду натрію 1,1 г/дм3, сульфату натрію 2,9 г/дм3. Установка виходила на стаціонарний режим за 5 год. Сила струму при цьому зростала від 18 до 28 А. Збільшення сили струму пов’язана з підвищенням температури діалізату та розсолу від 25 до 34,5 °С і зростанням солевмісту розсолу до 160-180 г/дм3. Солевміст діалізату при цьому коливався від 900 до 1300 мг/дм3. Ще одним прикладом для опріснення може бути виробництво каустичної солі, сульфатної кислоти за допомогою біполярних мембран.
Біполярна мембрана складається з 2-х мембран(катіонітової і аніонітової)
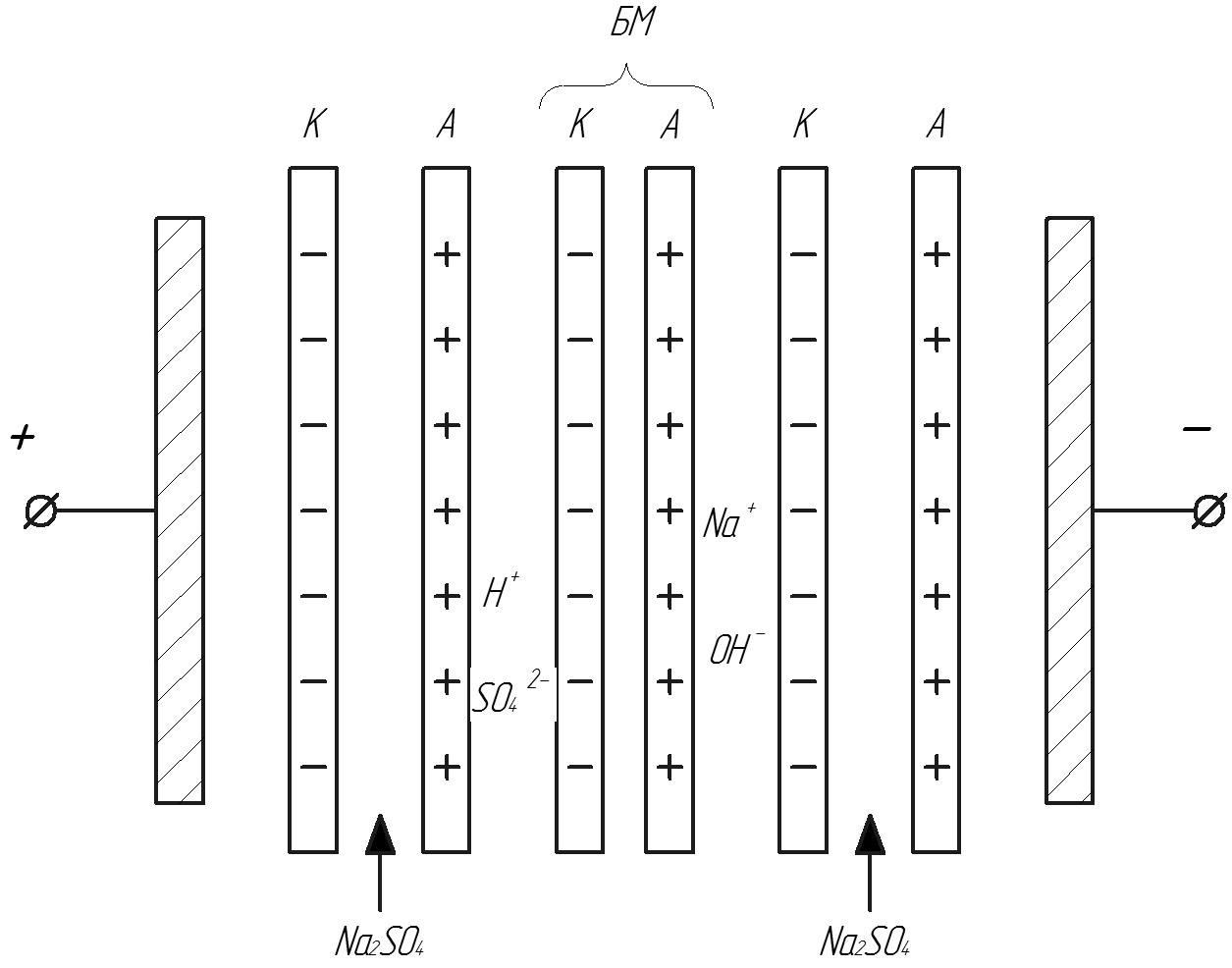
Рис.22. Отримання каустичної соди і сірчаної кислоти за допомогою біполярних мембран.
А – аніонітова мембрана;
К – катіонітова мембрана.
БП мембрани розміщують між К і А мембранами, розчин Na2SO4 подають у камери між К і А мембранами. Сульфат-іони проходять крізь А мембрани і рухаючись до аноду утворюють сірчану кислоту при взаємодії з протиіонами, що виробляються БП мембранами. Одночасно іони натрію проходять крізь К мембрану і рухаючись до катоду утворюють NaOH з гідроксоіонами, що виділяються на БП мембрані.
ЕД. ПАРАМЕТРИ ТА ВИКОРИСТАННЯ
Мембрани: - катіонітові, аніонітові, біполярні.
Товщина: 100-500 мкм.
Розмір пор: непористі.
Рушійна сила: різниця електричного потенціалу(поле постійного електричного струму).
Мембранний матеріал: зшиті сополімери.
Використання: знесолення води та концентрування розсолів, шахтних вод, фармація, харчова промисловість, розділення амінокислот, виробництво кислот та лугів.
ЕЛЕКТРООСМОС
Електрокінетичні явища, що спостерігаються у дисперсних системах: мембранах і капілярах(порах) включають: електроосмос, електрофорез, потенціал течії і потенціал осідання(седиментаційний потенціал – ефект Борна).
Електроосмос – це потік рідини у капілярах і пористих тілах спричинений зовнішнім електричним полем постійного електричного струму. Протилежне явище – потенціал течії – це поява різниці електричних потенціалів на кінцях капілярів або поверхні мембрани за течією рідини.
Електрофорез – рух твердих частинок чи краплин завислих в електроліті після прикладання ЕП. Протилежне явище – поява різниці електричних потенціалів на межі хмарки завислих частинок.
Головну роль у виникненні електрокінетичних явищ відіграє подвійний електричний шар, який формується біля поверхні поділу фаз. Зовнішнє електричне поле, що спрямоване вздовж межі поділу фаз спричиняє зміщення одного із іонних шарів, які утворюють ПЕШ, відносно іншого. Це приводить до відносного переміщення цих шарів, тобто до електроосмосу або електрофорезу. Аналогічно за відносного руху фаз, спричиненого механічними силами, відбувається переміщення іонних шарів ПЕШ, що призводить до просторового розділення зарядів(поляризація) у напрямку руху, і до перепаду електричного потенціалу(потенціал течії, потенціал седиментації). Розглянувши електроосмотичне ковзання електроліту в капілярі або порі мембрани, поверхня стінок яких заряджена негативно адсорбованими на ній і закріпленими нерухомо аніонами, а позитивно заряджені іони формують дифузійну частину ПЕШ. Електростатична сила, яка діє на будь-який елемент дифузійної частини ПЕШ, спричиняє рух цього елементу вздовж поверхні. При цьому зовнішнє поле Е має бути спрямоване також вздовж поверхні. Оскільки густина заряду в дифузійній частині ПЕШ Ф(х) змінюються залежно від відстані до поверхні різні шари рідкого електроліту рухатимуться з різними швидкостями. Стаціонарний стан, тобто незмінність у часі швидкості течії, досягається за умови, коли електростатичну силу, яка діє на довільний шар рідини, компенсують сили в’язкого опору. Ці сили виникають внаслідок різної швидкості руху шарів рідини, що перебувають на різних відстанях від поверхні.
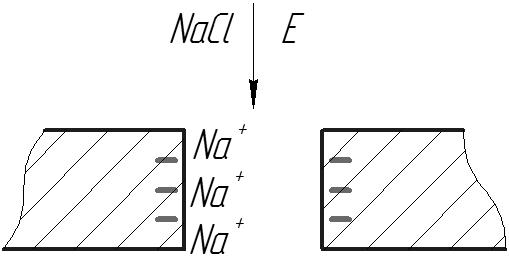
Рис.23
Рівняння гідродинаміки, які описують рух рідини за її сталої в’язкості μ і діелектричної проникності ε можна розрахувати. Результатами розрахунку є розподіл швидкості течії:
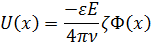
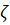 – електричний потенціал на відстані від поверхні, коли швидкість течії дорівнює 0(площина ковзання).
– електричний потенціал на відстані від поверхні, коли швидкість течії дорівнює 0(площина ковзання).
На великих відстанях від поверхні Ф(х) наближається до 0 і швидкість течії за межами дифузної частини ПЕШ є сталою.
Параметр 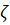 -потенціал, є однією з основних характеристик електрокінетичних явищ. Електрокінетичне явище протилежне електроосмосу – виникнення потенціалу течії, що розділяє камери з електролітом. За перепаду тиску Δ р течія рідини під дією цього перепаду створює потік об’ємом V. При цьому крізь мембрану проходить електричний струм природа якого – збільшення числа іонів рухомої частини ПЕШ. Оскільки у дифузійній частині ПЕШ є надлишок іонів одного знаку, формується конвективне перенесення заряду по порах мембрани. Якщо до розчинів розділених мембраною не підводиться струм, то з одного боку накопичується негативний заряд, а з іншого позитивний Це призведе до появи різниці потенціалів між ними і проходження електричного струму в усьому об’ємі електроліту в порах мембрани. Напрямок струму – протилежний конвективному перенесенню заряду. Накопичення заряду по обидва боки мембрани і збільшення різниці потенціалів триватиме доти, доки не відбудеться повна компенсація конвективного струму. Цьому стану відповідає різниця потенціалів, що носить назву потенціал течії. Електроосмос і електричний струм крізь мембрану(виникнення потенціалу течії) – перехресні явища зв’язані феноменологічними рівняннями, в рамках термодинаміки незворотних процесів.
-потенціал, є однією з основних характеристик електрокінетичних явищ. Електрокінетичне явище протилежне електроосмосу – виникнення потенціалу течії, що розділяє камери з електролітом. За перепаду тиску Δ р течія рідини під дією цього перепаду створює потік об’ємом V. При цьому крізь мембрану проходить електричний струм природа якого – збільшення числа іонів рухомої частини ПЕШ. Оскільки у дифузійній частині ПЕШ є надлишок іонів одного знаку, формується конвективне перенесення заряду по порах мембрани. Якщо до розчинів розділених мембраною не підводиться струм, то з одного боку накопичується негативний заряд, а з іншого позитивний Це призведе до появи різниці потенціалів між ними і проходження електричного струму в усьому об’ємі електроліту в порах мембрани. Напрямок струму – протилежний конвективному перенесенню заряду. Накопичення заряду по обидва боки мембрани і збільшення різниці потенціалів триватиме доти, доки не відбудеться повна компенсація конвективного струму. Цьому стану відповідає різниця потенціалів, що носить назву потенціал течії. Електроосмос і електричний струм крізь мембрану(виникнення потенціалу течії) – перехресні явища зв’язані феноменологічними рівняннями, в рамках термодинаміки незворотних процесів.
Ефект виникнення потенціалу течії використовується для перетворення механічної енергії електричну в датчиках тиску. Потенціал течії досліджують також при дослідженні зворотно осмотичного розділення розчинів електролітів і механізмів селективності зворотноосмотичних мембран.
ДІАЛІЗ
При діалізі розчинені речовини дифундують під дією градієнта концентрацій з одного боку мембрани до іншого, утворюючи діалізат(пермеат). Розділення розчинених речовин відбувається через різні швидкості їх перенесення крізь мембрану, що обумовлено різницею молекулярних розмірів. Для досягнення значного потоку, товщина мембрани повинна бути по можливості малою. Процес діалізу схематично показаний на рисунку:
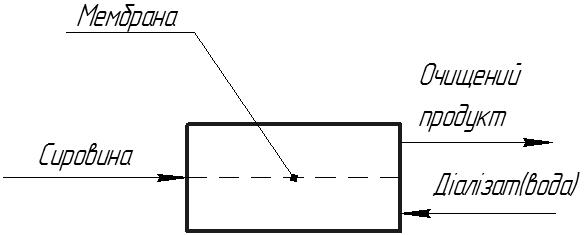
Рис.24. Схема процесу діалізу.
Транспорт речовини при діалізі відбувається в результаті дифузії крізь непористі мембрани і для того щоб знизити опір дифузії використовують мембрани, які сильно набухають. Низькомолекулярні іонні(солі) і нейтральні(сечовина) компоненти швидко проходять крізь мембрану у той час як транспорт більш високомолекулярних речовин зустрічає сильніший опір. Діаліз є дифузійним процесом і транспорт можна описати простим дифузійним рівнянням.
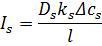
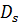 – коефіцієнт дифузії розчиненої речовини.
– коефіцієнт дифузії розчиненої речовини.
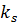 – коефіцієнт розчинності
– коефіцієнт розчинності
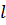 – товщина мембрани.
– товщина мембрани.
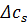 – різниця концентрації з обох боків мембрани.(
– різниця концентрації з обох боків мембрани.(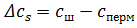 ).
).
Виникнення потоку розчиненої речовини, крізь мембрани призводить до одночасного осмосу розчинника у зворотному напрямі, який пропорційний різниці осмотичних тисків. Внаслідок дифузії розчиненої речовини різниця концентрацій по обидва боки мембрани зменшується, що призводить до зменшення різниці осмотичного тиску і зниження потоку розчинника. З іншого боку, потік розчинника призводить, до збільшення різниці концентрацій, що обумовлює зменшення потоку розчиненої речовини.
Із наведеного рівняння видно, що при проведенні процесу у протитечійному режимі концентрації з обох боків мембрани є функціями відстані від входу у мембранний елемент. Окрім того, може спостерігатися концентраційна поляризація, при якій опір перенесенню маси визначається не тільки мембраною, але й опором пограничних шарів. Діаліз використовують, головним чином, для відділення НМС від ВМС. Механізм такого розділення оснований на різниці молекулярних мас і визначається рівнянням Стокса-Ейнштейна.
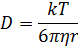
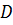 – коефіцієнт дифузії;
– коефіцієнт дифузії;
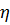 – в’язкість розчину;
– в’язкість розчину;
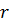 – радіус пор;
– радіус пор;
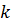 – коефіцієнт масо перенесення.
– коефіцієнт масо перенесення.
Рушійна сила діалізу – різниця концентрацій по обидва боки мембрани, а розділення ґрунтується на різниці молекулярних розмірів. Для досягнення достатніх швидкостей транспорту мембрани мають мати високий ступінь набухання, що неминуче пов’язано із зменшенням селективності, тому необхідно оптимізувати кожну систему з урахуванням швидкості дифузії, а також товщини мембрани.
Найважливіша область застосування діалізу – гемодіаліз, при якому діаліз використовують як штучну нирку, для людей, які страждають від ниркової недостатності.
Діалізні мембрани повністю заміняють нирку і здатні вилучити токсичні НМС і сечовину, фосфати, креатинин. Це досягається прокачуванням крові крізь діалізатор, який, як правило, представляє собою порожнисто-волоконний модуль.
Одна з головних вимог, які пред’являють мембранам – кровосумісність. Окрім токсичних елементів, крізь мембрану можуть дифундувати і нетоксичні речовини(Na+ і K+). Щоб нівелювати це, використовують, як фазу пермеату – фізіологічні розчини.
ГЕМОФІЛЬТРАЦІЯ
Інколи для вилучення із крові шкідливих продуктів метаболізму, використовують пористі мембрани. Такі процеси називають гемофільтрацією. У них використовуються УФМ. Процеси гемодіалізу і гемофільтрації суттєво відрізняються один від одного за своєю суттю. Перший ґрунтується на дифузії, а другий на конвекції. Оскільки швидкість гемофільтрації набагато більша ніж при гемодіалізі, необхідно бути обережним у зв’язку з можливим зневодненням організму пацієнта.
КОНЦЕНТРАЦІЙНА ПОЛЯРИЗАЦІЯ
КП – це профіль концентрації у над мембранному потоці, за якого в шарах прилеглих до мембрани, концентрація розчиненої речовини вища ніж у ядрі потоку, що переміщується, внаслідок перенесення крізь мембрану переважно розчинника. КП призводить до небажаних ефектів при проведенні фактично усіх мембранних процесів.
1. Внаслідок зростання концентрації біля поверхні мембрани, зменшується рушійна сила процесу. Для баромембранних процесів рушійна сила: 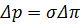 .
.
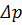 – різниця тиску по обидва боки мембрани;
– різниця тиску по обидва боки мембрани;
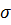 – коефіцієнт відбивання;
– коефіцієнт відбивання;
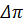 – різниця осмотичного тиску.
– різниця осмотичного тиску.
Не зважаючи на порівняно низький осмотичний тиск розчинів ВМС через значні концентрацію і в’язкість розчинів, що підлягають фільтруванню і порівняно низький робочий тиск, у процесі УФ вплив 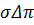 може бути сумірним з
може бути сумірним з 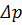 .
.
2. У разі перевищення точки гелеутворення(розчини полімерів і їх розділення) або добутку розчинності(розчини органічних НМС і колоїдів), на поверхні мембрани формуються тверді осади або гелеві шари, які призводять до різкого зростання гідравлічного опору мембрани, що призводить до зменшення продуктивності. Більше того, за наявності гелю змінюються початкові розділювальні характеристики мембрани.
3. За підвищеної концентрації речовин біля поверхні мембрани, вона може частково руйнуватися або модифікуватися. Отже, усі наведені чинники помітно впливають на розділювальні характеристики мембран, у будь-якому мембранному процесі і, як правило, погіршують їх.
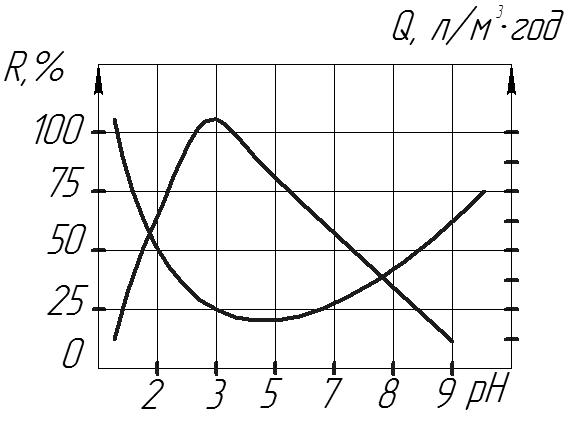
Рис.25
Модельний опис концентраційної поляризації
Зазвичай розглядають три моделі систем:
1. Неперемішувана закрита.
2. З ламінарним тангенціальним потоком.
3. З турбулентним потоком розчину над мембраною.
Найпростішим є третій випадок. За турбулентного режиму подачі початкового розчину фізичне моделювання ґрунтується на плівковій моделі Нернста(моделі граничного концентраційного шару). Згідно з цією моделлю, біля поверхні існує дуже тонкий н
 2015-08-13
2015-08-13 4070
4070