Сибирский Государственный Университет
Путей Сообщения
Кафедра «Естествознание»
Доклад на тему:
«Агрегатные состояния вещества»
Выполнила:
Студентка гр.МЛ-111
Сотова А.И.
Проверил:
доцент
Марков В.А.
Содержание
1. Введение…………………………………………………………………………………………………………………………………..2
2. Газообразное состояние вещества:
2.1 Изопроцессы…………………………………………………………………………………………………………………….2,3
2.2 Особенности газов под высоким давлением…………………………………………………………………….3
2.3 Особенности газов при нагревании……………………………………………………………………………………3
2.4 Физические свойства газов…………………………………………………………………………………………………3
3. Жидкое состояние вещества:
3.1 Физические свойства жидкостей……………………………………………………………………………………….4
4. Твёрдые тела:
4.1 Аморфные тела……………………………………………………………………………………………………………….....5
4.2 Кристаллическое состояние тел……………………………………………………………………………………….. 5
5. Плазма:
5.1 Физические свойства плазмы………………………………………………………………………………………….5,6
5.2 Получение плазмы……………………………………………………………………………………………………………..6
6. Переход вещества из одного агрегатного состояния в другое…………………………………………...6,7
7. Конденсат Бозе-Эйнштейна……………………………………………………………………………………………………..7
8. Список используемой литературы…………………………………………………………………………………………..8
9. Приложение
Введение
Агрегатные состояния вещества - это состояния одного и того же вещества, переходам между которыми соответствуют скачкообразные изменения свободной энергии, энтропии, плотности и других физических параметров вещества.Агрегатное состояние вещества зависит от физических условий, в которых оно находится, главным образом от температуры и от давления. Выделяют три основных агрегатных состояния: твёрдое тело, жидкость
и газ. Четвёртым агрегатным состоянием вещества считают плазму.Существуют и другие агрегатные состояния, например, жидкие кристаллы или конденсат Бозе -Эйнштейна.
Газообразное состояние вещества
-состояние вещества, в котором частицы не связаны или весьма слабо связаны силами взаимодействия; кинетическая энергия теплового движения его частиц (молекул, атомов) значительно превосходит потенциальную энергию взаимодействий между ними, поэтому частицы движутся почти свободно, целиком заполняя сосуд, в котором находятся, и принимают его форму. Любое вещество можно перевести в газообразное, изменяя
давление и температуру(т.е. газ не имеет форму,но имеет объём).
В газообразном состоянии всё вполне прозрачно — чем дальше частицы газа находятся друг от друга, тем меньше их взаимное отталкивание и тем меньше общая потенциальная энергия газа. Поэтому газу энергетически выгодно равномерно заполнить весь выделенный ему объём. Этим же объясняется и низкое давление на стенки разреженных газов — ведь межмолекулярные расстояния там велики, и сила отталкивания, передающаяся на стенки в виде давления газа,мала.Итак, Д.Г.зависит:
Во-первых, давление зависит от степени сжатия газа, т. е. от того, сколько молекул газа находится в данном объеме. Например, нагнетая в автомобильную шину все больше воздуха или сжимая (уменьшая объем) закрытую камеру, мы заставляем газ все сильнее давить_на_стенки_камеры. Во-вторых, давление зависит от температуры газа. Известно, например, что мяч становится более упругим, если его подержать вблизи нагретой печи.
Обычно изменение давления вызывается обеими причинами сразу: и изменением объема, и изменением температуры. Но можно осуществить процесс так, что при изменении объема температура будет меняться ничтожно мало или при изменении температуры объем практически останется неизменным.Состояние массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния. Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона: pV = mRT/M, где р — давление, V — объем, m — масса, М — молярная масса, R — универсальная газовая постоянная. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 ДжДмоль • К)).(Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение 3-х параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют 3 процесса: изотермический, изохорный и изобарный.
2.1 Изопроцесс - процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
Изотермический процесс - процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля—Мариотта: pV = const.
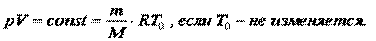
Изохорный процесс –процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля: V = const, p/T = const.
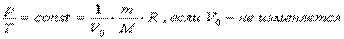
Изобарный процесс - процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T = const при р = const и называется законом Гей-Люссака. Все процессы можно изобразить графически.
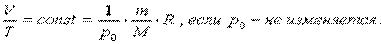
2.2Особенности газов под высоким давлением: Высокое давление газа означает большую силу взаимного отталкивания частиц газа, а следовательно, весьма высокую концентрацию его частиц. Поскольку сила отталкивания при этом велика, велико и давление на стенки сосуда, в котором находится газ, велика и потенциальная энергия этого газа, которая сразу проявится в виде его взрывного расширения, лишь стоит ограничивающим стенкам утратить необходимую прочность.Так как расстояния между частицами газа при высоком давлении относительно невелики, то силы отталкивания существенны в любом месте пространства между ними.
2.3Особенности газов при нагревании: При нагревании газа увеличивается скорость теплового движения его частиц, а значит и кинетическая составляющая его давления. Поэтому при росте температуры поведение любого газа начинает всё более походить на поведение разреженных газов, хотя абсолютное давление при этом растёт за счёт возрастания кинетической составляющей.Когда температура становится достаточно высокой, происходит тепловая ионизация частиц газа, они превращаются в ионы, а газ переходит в фазу плазмы.
2.4Физ.св-ва газов:
ü сжимаемость -отношение удельного объёма газа к удельному объёму идеального газа с такой же молярной массой.
ü Теплоёмкость газа сильно зависит от характера процесса, который с ним протекает
ü Вязкость. В отличие от жидкостей, кинематическая вязкость газов с ростом температуры растёт, хотя для динамической вязкости зависимость менее выражена. Также вязкость обратно пропорциональна давлению.
ü Проводимость. Газы — очень плохие проводники, но в ионизированном состоянии газ способен проводить электрический ток. Проводимость газа зависит от напряжения нелинейно, поскольку степень ионизации изменяется по сложному закону. Основных способов ионизации газа два: термическая ионизация и ионизация электрическим ударом. Кроме того, существует так называемый самостоятельный электрический разряд (пример — молния).
ü Термическая ионизация - придание атомам достаточной кинетической энергии для отрыва электрона от ядра и последующей ионизации вследствие повышения температуры газа и тепловое движение атомов газа, приводящее к столкновениям и превращением их в кинетическую энергию.
 2015-08-12
2015-08-12 12644
12644