1. Записати вихідні дані експерименту: rСu = (8,60 ± 0,01)103 кг/м3;
rFe = (7,80 ± 0,01)103 кг/м3; rAl = (2,69 ± 0,01)103 кг/м3.
Питома теплоємність міді за різних температур, Дж/кг ∙ К:
| t °С | |||||
| c ·10-3 | 0,398 | 0,402 | 0,404 | 0,408 | 0,413 |
2. Одягти електропіч 1 на мідний зразок і встановити перемикач термопари 4 в положення Сu.
3. Увімкнути живлення потенціометра 3 і секундоміра 2 (220 В).
4. Увімкнути живлення електропечі 1 і, стежачи за показами потенціометра, нагріти зразок до температури 300°С.
5. Вимкнути живлення електропечі, обережно зняти її зі зразка 6 і поставити на підставку.
6. Запустити секундомір 2 і через кожні 20 с записувати температуру зразка, стежачи за шкалою потенціометра 3. Вимірювання закінчити, якщо зразок охолодився до 100°С. Результати вимірювань записати в таблицю.
7. Виконати аналогічні експерименти з залізним та алюмінієвим зразками.
8. Побудувати на міліметровому папері графіки залежності Т °С =f (t)для кожного металу.
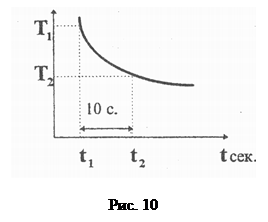
9. Визначити графічно значення dT/dt за заданих температур. Для цього необхідно розбити графіки вертикальними лініями, проведеними через кожні 10 с (див. рис. 10). Тоді
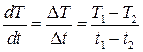 ,
,
а температуру, яка відповідає цьому значенню dT/dt, визначають як
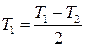 .
.
10. Побудувати графіки залежності dT/dt=f (T)для всіх зразків (див. рис. 10). З отри-маних графіків визначити dT/dt для температур 140, 160, 180, 200 і 240°С. Результати записати в таблицю.
11. Обчислити за формулою (5) питомі теплоємності заліза та алюмінію за температур, зазначених у п. 9.
| Номер за пор. | t, с | T Cu, °С | T Fe, °С | T Al, °С |
| …. | ||||
| n |
| Номер за пор. | t, °С | dT/dt, °С /c | с · 103, Дж/кг · К | ||
| Fe | A l | Fe | A l | ||
| …. | …. | ||||
Контрольні запитання
1. Сформулюйте і запишіть перший закон термодинаміки.
2. Яке формулювання закону Дюлонга і Пті?
3. Дайте визначення теплоємності та питомої теплоємності тіл.
4. Який процес називають теплопередаванням?
5. У чому полягає фізичний зміст коефіцієнта теплопередавання?
6. Поясніть суть графічного методу визначення швидкості охолодження металу dT/dt.
7. Запишіть співвідношення між сp і cv для ідеального газу та кристалічного тіла.
Лабораторна робота № 210. ВИЗНАЧЕННЯ СТАЛОЇ БОЛЬЦМАНА ТА УНІВЕРСАЛЬНОЇ ГАЗОВОЇ СТАЛОЇ
Завдання: визначити експериментально сталу Больцмана й обчислити універсальну газову сталу.
Приладдя: установка для визначення сталої Больцмана; рідина, яка легко випаровується за кімнатної температури (діетиловий ефір, етиловий спирт, ацетон); шприц медичний.
Теоретичний матеріал, який необхідно засвоїти під час підготовки до виконання роботи: ідеальний газ, рівняння Менделєєва–Клапейрона, закони Авогадро і Дальтона, основне рівняння молекулярно-кінетичної теорії, фізичний зміст сталої Больцмана й універсальної газової сталої.
Література:
1) § 14.5, c. 241–247;
2) § 13.1–13.2, c. 129–138;
3) § 42–44, с. 129–138;
4) § 41–43, с. 73–78.
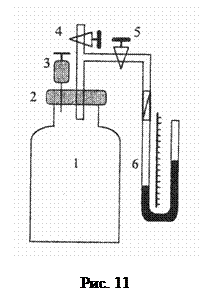 Опис установки. Експериментальна установка (рис. 11) складається зі скляної посудини 1, закритої корком 2, у який герметично вставлені голка шприца 3 і скляна трубка з кранами 4 і 5. Кран 5 з’єднаний гумовою трубкою з водяним манометром 6.
Опис установки. Експериментальна установка (рис. 11) складається зі скляної посудини 1, закритої корком 2, у який герметично вставлені голка шприца 3 і скляна трубка з кранами 4 і 5. Кран 5 з’єднаний гумовою трубкою з водяним манометром 6.
Ідея роботи та виведення робочої формули. Визначення сталої Больцмана в цій роботі ґрунтується на використанні рівняння стану ідеального газу Менделєєва–Клапейрона
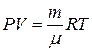 (1)
(1)
та співвідношення між універсальною газовою сталою R і сталою Больцмана k
R=kNA, (2)
де NA = 6,022 •1023 моль-1– число Авогадро.
Як модель ідеального газу в цій роботі використовують пару рідини, яка швидко випаровується за кімнатної температури (наприклад, діетиловий ефір). Якщо порцію ефіру масою m вприснути у закриту посудину об’ємом V 0, то тиск у посудині збільшиться від Р 0 до Р 0 +D Р, де Р 0 – атмосферний тиск, а D Р –парціальний тиск пари ефіру. Стан пари ефіру описує рівняння (1). Тоді з (1) і (2) отримаємо
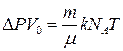 , (3)
, (3)
де m – молекулярна маса ефіру; Т – абсолютна температура.
У роботі парціальний тиск пари ефіру вимірюють манометром 6:
D P = r 0 gh, (4)
де r 0 – густина рідини; h – різниця рівнів рідини в манометрі.
Масу ефіру можна обчислити як
m = rV, (5)
де r – густина, а V – об’єм ефіру, який уводять у посудину.
Якщо тепер формули (4) і (5) підставити у (3), то отримаємо вираз для розрахунку сталої Больцмана:
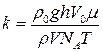 . (6)
. (6)
Вирази (6) і (2) є робочими формулами лабораторної роботи.
 2015-08-21
2015-08-21 293
293








