Методическая разработка
к лабораторной работе по ХРМ №2
«Физико-химический способ определения свойств вещества. Определение показателя преломления диэлектриков с помощью рефрактометра»
Составитель: к. т. н., доцент Гончарова Г. Н.
Самара, 2005г
Рефрактометрия
Метод анализа и исследования веществ, основанный на измерении показателя преломления n (коэффициент рефракции). Для монохроматического света при постоянной температуре n зависит от химического состава и структуры вещества. Рефрактометрические измерения проводят в видимой части спектра по отношению к воздуху. При этом используют рефрактометры Аббе, конструкция которых основана на преломлении лучей в призме, рефрактометры Пульфриха, в которых измеряют предельный угол полного внутреннего отражения. Рефрактометрию применяют для анализа состава многокомпонентных систем, контроля качества веществ. В некоторых случаях вместо n используют другие рефрактометрические константы вещества, например, молярную рефракцию.
Рефракцию смеси веществ R можно вычислить, если известны рефракции r 1, r 2,... ее отдельных компонентов и их процентное содержание с1, с2,... в смеси:
100 R = c 1 r 1 + c 2 r 2 +...
Это означает, что оптическое поведение молекул каждой компоненты остается тем же независимо от того, взята ли данная компонента отдельно или в смеси с другими. Еще большее значение имеет правило, согласно которому рефракцию сложного химического соединения можно вычислить, складывая рефракции элементов, его составляющих. Для каждого элемента удобно ввести понятие атомной рефракции, представляющей произведение атомного веса элемента a 1 на его удельную рефракцию r 1. Если молекулярный вес соединения есть М, а его удельная рефракция равна R, то MR называется молекулярной рефракцией. Опыт показывает, что молекулярную рефракцию часто можно вычислять аддитивно из атомных рефракций, пользуясь химической формулой (При этом надо учитывать наличие кратных химических связей и других особенностей строения молекулы, от которых зависят отдельные слагаемые, входящие в сумму, определяющую молекулярную рефракцию). Другими словами,
MR =q1а 1 r 1 + q2 а2 r2 + q3 а3 r3 + …,
где q1, q2,... — числа атомов, входящих в состав молекулы. Это крайне важное правило нередко соблюдается очень хорошо. Например, для воды (НзО) измеренная молекулярная рефракция равна 3,71, а вычисленная — 3,73; для СНСlз измеренная — 21,36, вычисленная — 21,42 и т.д. Это правило означает, что влияние отдельных атомов на преломление света не нарушается влиянием других атомов, входящих м состав той же молекулы. Наоборот, нарушение правила аддитивном и позволяет судить о взаимном влиянии атомов друг на друга и может быть использовано для заключения о строении молекулы.
Таким образом, изучение рефракции (показателя преломлении) может служить ценным приемом для исследования химической природы молекул и для аналитических целей. Впервые обратил на это внимание М.В. Ломоносов, который еще около 1750 г. высказал мысль, о возможности определения химического состава прозрачного жидкого вещества по его показателю преломления и построил рефрактометр для такого рода исследований. В настоящее время рефрактометрические методы находят в химии широкое применение.
ПОЛЯРИЗУЕМОСТЬ атомов, ионов, молекул, способность этих частиц приобретать дипольный момент р в электрическом поле напряженностью Е. В относительно слабых полях
р = αЕ, где коэффициент α имеет размерность объема и является количественной, мерой поляризуемости (его также называют поляризуемость). Для некоторых молекул значение поляризуемости может зависеть от направления Е (анизотропная поляризуемость). В сильных электрических полях зависимость р от Е перестает быть линейной.
Напряженность Е характеризует поле в месте нахождения частицы; для изолированных частицы оно совпадает с внешним полем; в жидкости или кристалле к внешнему полю добавляются поля, создаваемые окружающими заряженными частицами.
При включении поля момент р появляется не мгновенно; время t его установления зависит от природы частиц и окружающей среды. Статическому полю отвечает статическое значение поляризуемости. В переменном поле, например, изменяющемся по гармонич. закону, поляризуемость зависит от t и частоты поля ω. При достаточно низких ω и коротких t момент р устанавливается синфазно с изменениями поля и поляризуемость совпадает со статичным значением. При очень высоких ω или больших t частица «не чувствует» присутствия поля и поляризуемости нет. В промежуточных случаях (особенно при ω ≈1/ t) наблюдаются явления дисперсии и поглощения энергии поля.
Различают несколько видов поляризуемости. Электронная поляризуемость обусловлена смещением в поле электронных оболочек относительно атомных ядер; ионная поляризуемость (в ионных кристаллах) — смещением в противоположных направлениях разноименно заряженных ионов из положения равновесия; атомная поляризуемость — смещением атомов разного типа в молекуле (она связана с несимметричным распределением в молекуле электронной плотности).
Связь между поляризуемостью и макроскопическими свойствами вещества позволяет определять ее экспериментально. Электронная поляризуемость αэ связана с показателем преломления n и молекулярной рефракцией R формулойлой Лоренц — Лорентца:
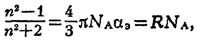
где n a — число Авогадро. Эта формулала служит основой рефрактометрии и справедлива для высоких частот внешнего поля, соответствующих видимому и УФ диапазонам. При более медленных колебаниях поля (например, в ИК диапазоне) приходится учитывать и атомную поляризуемость, т. к. в таком поле успевают сместиться не только электроны, но и ионные остовы. В этом случае суммарная поляризуемость α связана с диэлек-трической проницаемостью ε формулой Клаузиуса — Моссоти:
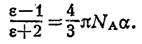
Поляризуемость полярных молекул с собственным дипольным моментом определяется уравнением Лавжевена — Дебая:
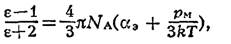
где k — постоянная Больцмана, Т — абсолютная температура.
 2015-09-06
2015-09-06 1513
1513







