Ідеальним називають такий газ, для якого можна знехтувати розмірами молекул та силами молекулярної взаємодії. Молекули в такому газі співударяються за законом співударяння пружних куль. Реальні гази поводять себе як ідеальний тоді, коли середня відстань між молекулами у багато разів перевищує їхні розміри, тобто коли розрідження досить велике. Газ може бути в різних станах, тобто деяка маса газу має об’єм V, тиск p і температуру Т. Величини V, p,Т, що характеризують стан газу, називаються термодинамічними параметрами. Процеси, що відбуваються при сталому значенні одного з параметрів стану (Т, V або p) з певною сталою масою газу, називаються ізопроцесами.
Ізотермічний процес- процес, що відбувається при сталій температурі (Т= const). За законом Бойля-Маріотта, тиск даної маси газу при сталій температурі обернено пропорційний об’єму газу. Отже,
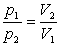 або р1V1=р2V2= const.
або р1V1=р2V2= const.
Криву залежності тиску газу від його об’єму при сталій температурі називають ізотермою.
Графік залежності між параметрами газу при Т = const (Рис. 24).
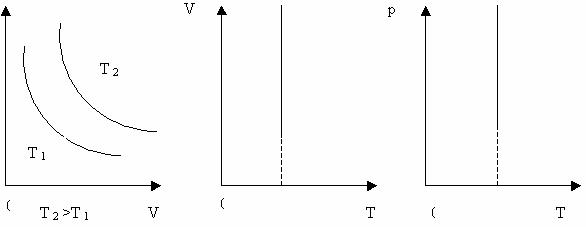
Рисунок 22
Ізобаричний процес – процес, який відбувається при сталому тиску
(р=const).
Виходячи із закону Гей-Люссака, відносна зміна об’єму даної маси газу в ізобарному процесі прямо-пропорційна зміні температури t.
Отже, 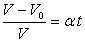 або V=V0(1 –? t) або
або V=V0(1 –? t) або 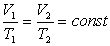
V0- об’єм газу при t = 0 оС, V- його об’єм при температурі t,? – термічний коефіцієнт об’ємного розширення. Для всіх газів:
? = 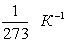
Криву залежності об’єму газу від температури при сталому тиску називають ізобарою.
Графік залежності між параметрами при р= const (Рис. 25).
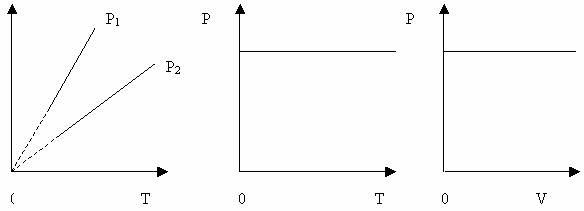
Рисунок 23
Вищому тиску відповідає нижча ізобара. Штрихи означають, що закон Гей-Люссака в області низьких температур не застосовується. Об’єм не може перетворитися в нуль при температурі – 273 0С.
Ізохоричний процес – це процес, який відбувається при сталому об’ємі (V = const). Виходячи із закону Шарля, тиск даної маси газу при сталому об’ємі пропорційний його абсолютній температурі:
р = р0 (1+ jt)
р0 - тиск при 0 0С, j – термічний коефіцієнт тиску газу.
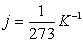 або
або 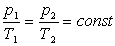
Залежність тиску газу від температури при сталому об’ємі графічно зображається прямою, яка називається ізохорою. Меншому об’ємі відповідає ізохора, що лежить вище.
Графік залежності між параметрами при сталому об’ємі V = const (Рис. 26). 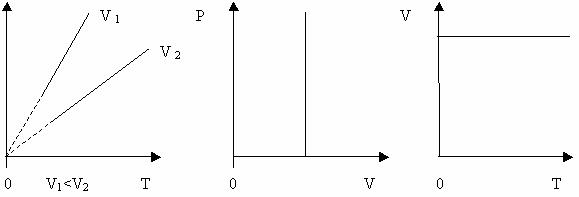
Рисунок 14
Виходячи з закону Шарля, можна знайти температуру, при якій тиск газу буде дорівнювати нулеві.
p=p0(1+jt), 0=p0(1+jt)
Оскільки p0?0, то 1+jt =0 або t =-2730C.
Температуру - 273,160С називають абсолютним нулем температур.
Англійський вчений У.Томсон запропонував абсолютну шкалу температур. За абсолютний нуль було прийнято температуру t = - 2730C
(точніше t0 = - 273,160С) абсолютна температура Т пов’язана з
температурою t за шкалою Цельсія таким співвідношенням:
Т= t + 2730C
В шкалі Цельсія за 00С прийнято температуру танення льоду при нормальному тискові, за 1000 С – температуру кипіння води при нормальному тискові.
В шкалі Кельвіна за 0 прийнято температуру, при наближенні до якої
швидкість поступального руху молекул ідеального газу прямує до нуля, а 1 кельвін відповідає 1/100 інтервалу температур між температурами танення льоду і кипіння води за нормального тиску.
За шкалою Фаренгейта:
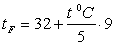
Основна одиниця температури в СІ є кельвін – [ Т ] = К.
Змінюючи всі три параметра р, V і Т газу і користуючись газовими законами можна отримати рівняння Клапейрона.
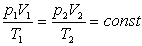
Добуток тиску даної маси газу на об’єм, поділений на абсолютну температуру, є величиною сталою.
При t = 00C, р = 1,013 · 105Па один моль будь-якого газу має об’єм V0 =22,4?10-3м3. Підставивши ці дані в закон Клапейрона, отримуємо значення константи, яка є однакова для будь-якого 1 моля газу. Її називають молярною універсальною газовою сталою.
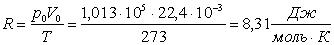
A для одного моля газу тепер можна записати:
p0V0=RT
Цей вираз називають рівнянням Менделєєва – Клапейрона.
А для будь-якої маси газу рівняння Менделєєва – Клапейрона матиме вигляд:
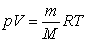
Якщо в об’ємі V знаходиться суміш газів, які не реагують один з одним, то використавши рівняння Менделєєва – Клапейрона, визначимо тиск:
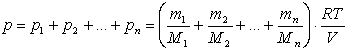
де ті, Мі – маса і молярна маса і – го газу. Закон Дж. Дальтона:
«Тиск суміші газів дорівнює сумі парціальних тисків газів, з яких складається дана суміш».
Парціальним тиском називається тиск, який був би створений за даних умов (Т, V) окремо одним газом з суміші.
 2015-09-06
2015-09-06 819
819








