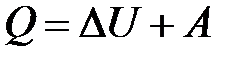 – I начало термодинамики.
– I начало термодинамики.
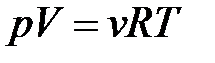 – уравнение состояния идеального газа.
– уравнение состояния идеального газа.
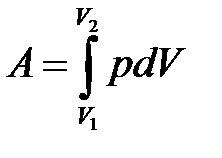 – определение работы.
– определение работы.
Если расширение Δ V > 0, то A > 0; если A > 0, то Δ V > 0.
Если сжатие Δ V < 0, то A < 0; если A < 0, то Δ V < 0.
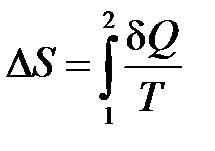 – определение приращения энтропии.
– определение приращения энтропии.
Если получение тепла Q > 0, то Δ S > 0; если Δ S > 0, то Q > 0.
Если отдача тепла Q < 0, то Δ S < 0; если Δ S < 0, то Q < 0.
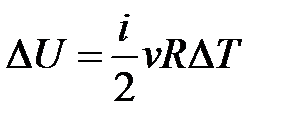 – определение приращения внутренней энергии идеального газа.
– определение приращения внутренней энергии идеального газа.
Если нагревание Δ T > 0, то Δ U > 0; если Δ U > 0, то Δ T > 0.
Если остывание Δ T < 0, то Δ U < 0; если Δ U < 0, то Δ T < 0.
Обратимые изопроцессы идеального газа в неизолированной системе
Изобарный процесс ( ) )
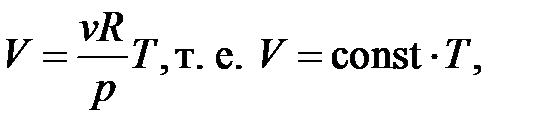
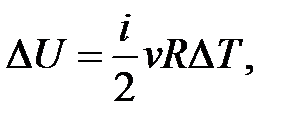
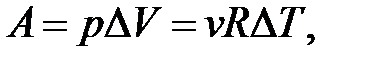
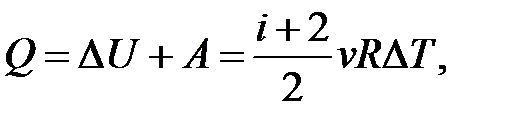

| Изотермический процесс ( ) )
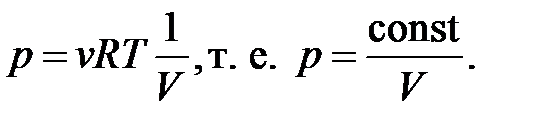
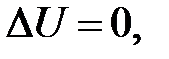
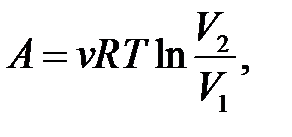
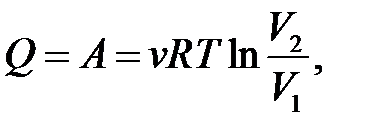
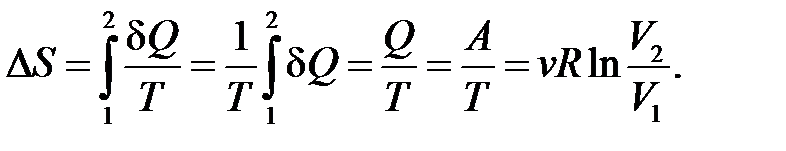
|
Изохорический процесс (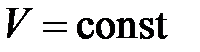 ) )
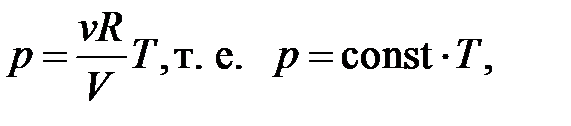
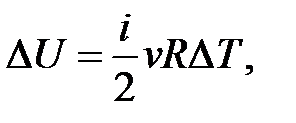
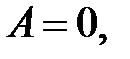
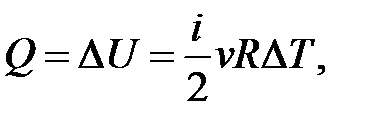
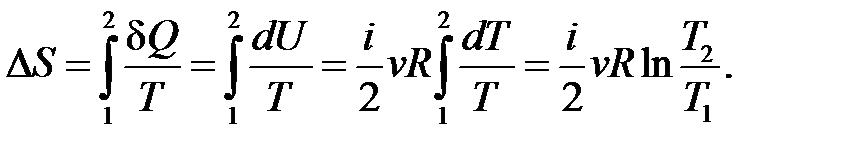
| Адиабатический процесс (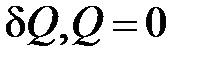 ) )
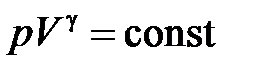 , , 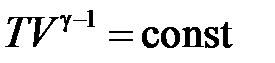 , , 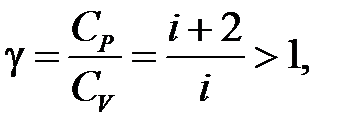
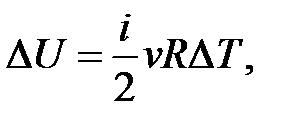
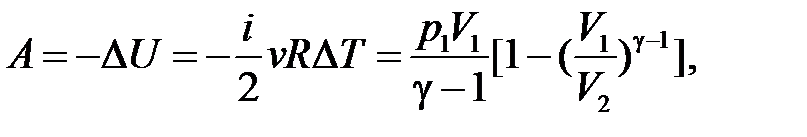
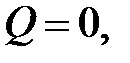
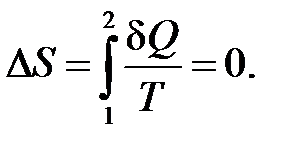
|
Изменение температуры и энтропии при обратимыхпроцессах нагревания (остывания) и агрегатного (фазового) превращения вещества в неизолированной системе.
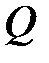
|
| 1-2 кристалл нагревание (остывание) 2-3 кристалл + жидкость плавление (кристаллизация) 3-4 жидкость нагревание (остывание) 4-5 жидкость + газ кипение (конденсация) 5-6 газ нагревание (остывание) |
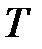
|
Для твердого тела и жидкости 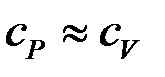 . Для газа
. Для газа  .
.
Нагревание (остывание) фазы – 
Для твердого тела и жидкости 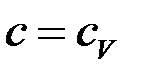 .
.
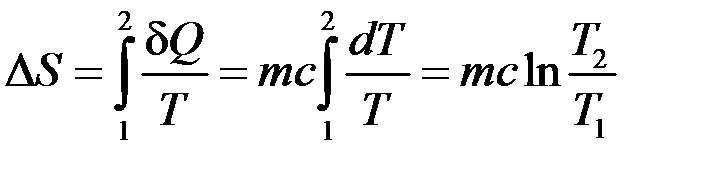 .
.
Нагревание твердого тела ( 1 → 2),жидкости ( 3 → 4)и газа ( 5 → 6).
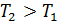 →
→ 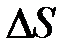 > 0, т. е.
> 0, т. е. 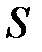 растет.
растет.
Остывание газа ( 6 → 5), жидкости ( 4 → 3)и твердого тела ( 2 → 1).
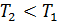 →
→ 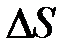 < 0, т. е.
< 0, т. е. 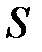 падает.
падает.
Агрегатный (фазовый) переход – 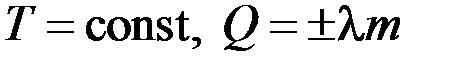 .
.
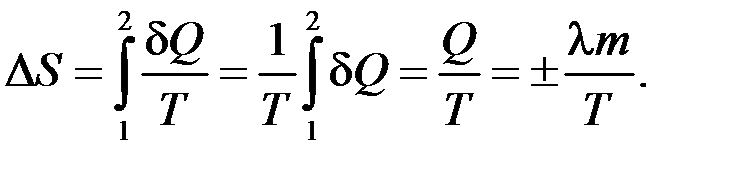
 2015-09-06
2015-09-06 364
364








