Гази, які знаходяться в одному об’ємі і які не вступають в хімічну реакцію, мають назву суміші газів.
Згідно з законом Дальтона, тиск суміші дорівнює сумі парціальних тисків газів, що в неї входять:
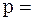
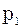 +
+ 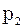 +...+
+...+ 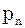 ,
,
р – тиск суміші;
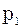 ,
, 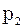 ,...,
,..., 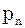 – парціальний тиск компоне-нтів.
– парціальний тиск компоне-нтів.
За законом Амага об’єм суміші ідеаль-них газів v дорівнює сумі парціальних об’є-мів 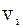 окремих компонентів:
окремих компонентів:
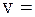
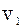 +
+ 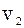 +
+ 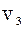 +…+
+…+ 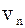 = ∑
= ∑ 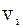
Парціальним об’ємом компонента сумі-ші газів називається об’єм, який би займав цей компонент при тиску і температурі су-міші. Рівняння стану для кожного компо-нента:
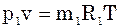 ;
;
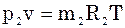 ;
;
………
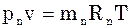 .
.
Тобто, 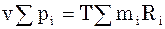 .
.
Оскільки 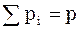 , то
, то 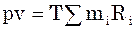 ,
,
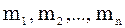 – маса даного компонента в суміші газів;
– маса даного компонента в суміші газів;
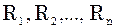 – газова стала даного компо-нента.
– газова стала даного компо-нента.
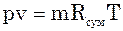
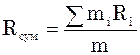
Кількісне співвідношення окремих га-зів, які входять до суміші, може бути зада-но масовими, об’ємними і мольними част-ками. Масова частка – це відношення ма-си 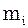 компонента до маси m газової суміші. Позначається
компонента до маси m газової суміші. Позначається 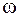 .
.
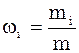
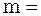
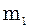 +
+ 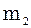 +…+
+…+ 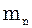 =
= 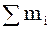
Отже, 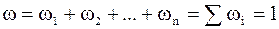
Об’ємною часткою називається відно-шення парціального об’єму компонента 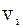 до об’єму
до об’єму 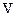 газової суміші і позначається
газової суміші і позначається 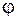 .
.
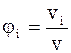
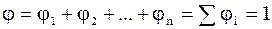
Оскільки 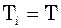 , то
, то 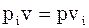 , тому
, тому
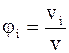 .
.
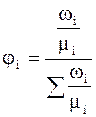
Мольна частка – це відношення числа молей даного газу 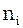 до числа молей сумі-ші газів n; позначається
до числа молей сумі-ші газів n; позначається 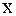 .
.
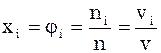
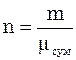
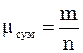
Величина 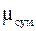 називається середньою уя-вною молекулярною масою газової суміші і дорівнює дійсній молекулярній масі деяко-го однорідного газу, який, також як і суміш, при однаковій загальній масі m має одне і те ж саме число молей n.
називається середньою уя-вною молекулярною масою газової суміші і дорівнює дійсній молекулярній масі деяко-го однорідного газу, який, також як і суміш, при однаковій загальній масі m має одне і те ж саме число молей n.
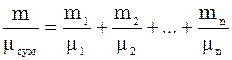
Поділимо ліву і праву частину рівності на m. З отриманого рівняння виразимо 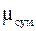 .
.
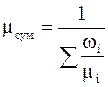
знайдемо залежності 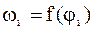 та
та 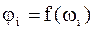 .
.
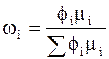
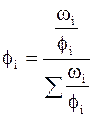 ;
; 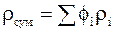 ;
;
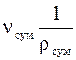 ;
; 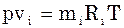 ;
;
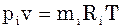 ;
;
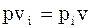 ;
; 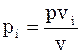 ;
; 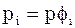 ;
;
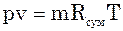 (1)
(1)
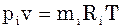 (2)
(2)
Поділимо друге рівняння на перше:
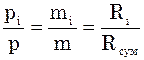 ;
; 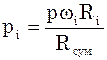 ;
;
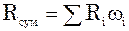 .
.
Також є справедливою формула:
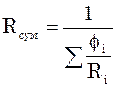 .
.
Всі наведені співвідношення справед-ливі для газової суміші, якщо її розглядати як ідеальний газ.
 2015-09-06
2015-09-06 568
568








