1. Після визначення теплового ефекту розчинення солі KNO3 (сталої калориметра) калориметр звільняють від розчину, корки висушують, пробірки витирають тампоном з фільтрувального паперу.
2. В пробірку вносять невідому сіль і зважуванням визначають її масу.
3. Збирають калориметричну установку (рис. 1.1) і, відповідно до п. 5, 6, 7 лабораторної роботи № 1.1 здійснюють процес розчинення невідомої солі, будують графік залежності t=f(t), визначають стрибок температури Δtта розраховують калориметричний тепловий ефект за формулою (1.10).
Опрацювання результатів
1. Обчислюють питому теплоту розчинення невідомої солі (теплота розчинення 1 г), Дж/г:
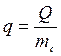 (1.14)
(1.14)
де Q – калориметричний тепловий ефект; mс – маса солі.
Перевіряють одержаний результат у викладача, порівнюючи з табличним значенням.
2. Знаючи назву солі і, відповідно, її молярну масу (М, г/моль)), визначають інтегральну теплоту розчинення цієї солі D Нр, кДж/моль
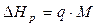 (1.15)
(1.15)
3. Знайдену інтегральну теплоту розчинення порівнюють з табличним значенням і обчислюють відносну похибку експерименту за формулами (1.16).
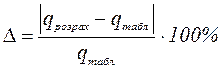 ;або
;або 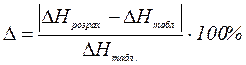 (1.16)
(1.16)
Питання для самоперевірки
1. Сформулюйте перший закон термодинаміки та наведіть його аналітичний вираз.
2. Дайте визначення внутрішньої енергії системи. Яка функція називається функцією стану?
3. Сформулюйте закон Гесса.
4. Що називається тепловим ефектом хімічної реакції?
5. В яких випадках застосовують закон Гесса для розрахунку теплових ефектів?
6. Які теплові ефекти виникають під час розчинення солі?
7. Що називається теплотою розчинення речовини?
8. Що розуміють під інтегральною і диференціальною теплотами розчинення речовини?
9. В чому суть калориметричного способу вимірювання теплового ефекту?
10. Що таке стала (водяний еквівалент) калориметра і як її визначають?
11. Чому для визначення D t необхідно накреслити графік зміни температури з часом?
 2015-09-06
2015-09-06 232
232








